
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
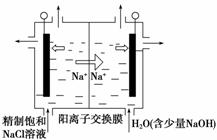
①图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为_____________________________________________________________
________________________________________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:_____________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为_________________________________________________
________________________________________________________________________。
若以该电池为电源,用石墨作电极电解100 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将 Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用右 图装置模拟上述过程:
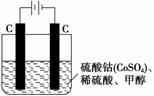
①写出阳极电极反应式:_________________________________________________。
②除去甲醇的离子反应为6Co3++CH3OH+H2O===CO2↑+6Co2++6H+,该过程中被氧化的元素是__________,当产生标准状况下2.24 L CO2时,共转移电子________ mol。
答案 (1)①Cl--5e-+2H2O===ClO2↑+4H+
②0.01 在阴极发生2H++2e-===H2↑,H+浓度减小,使H2OH++OH-的平衡向右移动,OH-浓度增大,pH增大
(2)O2+4e-===2O2- 0.1
(3)①Co2+-e-===Co3+ ②C(或碳) 0.6
解析 (1)①阳极失去电子发生氧化反应。②水电离产生的H+在阴极上放电产生氢气,转移电子的物质的量n=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,则在内电路中移动的电荷为0.01 mol,每个Na+带一个单位的正电荷,则通过的Na+为0.01 mol。(2)电池工作时,正极上O2得电子发生还原反应生成O2-。结合离子浓度可知电解过程可分为三个阶段:先是电解CuCl2、然后电解HCl、最后电解水,由此可见阴极首先析出0.1 mol Cu(同时阳极析出0.1 mol Cl2),然后析出氢气;阳极上先是析出 0.2 mol Cl2(此时阴极已析出0.1 mol H2),再析出氧气,设阳极析出 x mol O2时两极析出气体体积相等,由题意可得:0.2+x=0.1+2x,解得x=0.1。(3)②利用方程式可知Co3+被还原,甲醇中碳元素被氧化,依据方程式可知生成1 mol CO2时,有6 mol Co3+还原为Co2+,可知转移电子6 mol,由此可推知当产生标况下2.24 L CO2(0.1 mol)时,转移电子0.6 mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有A、B、C、D、E、F六种元素,期中A、B、C、D、E为短周期元素, 且原子序数依次增大。已知A和B具有相同的电子层数, 且A的L层电子数是K层电子数的两倍; C单质燃烧时呈现黄色火焰, C单质在高温下与B单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物; E元素的最低负价为负一价;F元素位于周期表中第四周期,它的氧化物中有一种常做涂料和红色油漆。试根据以上叙述回答:
(1)写出下列元素的名称: A ________, D ___________。
(2)写出B元素在周期表中的位置 。
(3)用电子式表示化合物 C2D 的形成过程 ___________________________。
(4)A与B形成的化合物均对环境能产生影响,请你写出一例 。
(5)写出B单质与C单质反应生成淡黄色化合物M的化学方程式 ;写出一例M的用途_______________。
(6)如何检验FE2溶液中的金属阳离子(答操作、现象及结论)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)所有金属纯度越大,越不易被腐蚀 ( )
(2)纯银器表面变黑和钢铁表面生锈腐蚀原理一样 ( )
(3)干燥环境下金属不被腐蚀 ( )
(4)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物 ( )
(5)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+ ( )
(6)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
(7)外加电流的阴极保护法,构成了电解池;牺牲阳极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电解原理的叙述正确的是 ( )
A.为防止轮船腐蚀,将轮船的外壳与外电源的负极相连
B.在锌片上镀铜,用氯化锌溶液作电镀液
C.电解氯化钠溶液制备氢气和氯气时,用铁作阳极
D.用电解法精炼铜时,在阴极上可析出铁
查看答案和解析>>
科目:高中化学 来源: 题型:
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中,正确的是 ( )
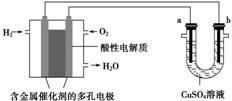
A.燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B.a 极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是 ( )

A.反应①是加成反应
B.只有反应②是加聚反应
C.只有反应⑦是取代反应
D.反应④⑤⑥是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
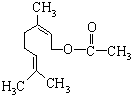
乙酸橙花酯是一种食用香料,结构如图所示。下列关于该有机物的说法有如下几种:
①该有机物有一种同分异构体属于酚类;
②该有机物属于酯类;
③该有机物不能发生银镜反应;
④该有机物的分子式为C11H18O2;
⑤1mol该有机物最多能与1mol NaOH反应。其中正确的是
A.①③④ B.②③⑤ C.①④⑤ D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com