
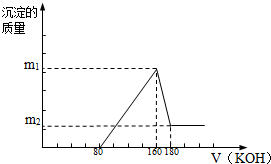
分析 由图象可知,从开始至加入KOH溶液80mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(KOH溶液)=160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时溶液中溶质为K2SO4,根据钠元素守恒可知此时n(K2SO4)等于160mL氢氧化钾溶液中含有的n(KOH)的0.5倍;从160mL到180mL,NaOH溶解Al(OH)3:KOH+Al(OH)3=KAlO2+2H2O,当V(KOH溶液)=180mL时,沉淀不再减少,此时全部为Mg(OH)2,溶解氢氧化铝消耗了20mLKOH溶液,根据反应KOH+Al(OH)3=KAlO2+2H2O可计算出氢氧化铝的物质的量,再结合铝元素守恒可知生成氢氧化铝沉淀消耗KOH的量,从而可知生成氢氧化镁消耗KOH的物质的量,结合反应可计算出氢氧化镁的物质的量,据此进行计算.
解答 解:由图象可知,从开始至加入KOH溶液80mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(KOH溶液)=160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时溶液中溶质为K2SO4,根据钠元素守恒可知此时n(K2SO4)等于160mL氢氧化钾溶液中含有的n(KOH)的0.5倍;从160mL到180mL,NaOH溶解Al(OH)3:KOH+Al(OH)3=KAlO2+2H2O,当V(KOH溶液)=180mL时,沉淀不再减少,此时全部为Mg(OH)2,
(1)溶解氢氧化铝消耗了20mLKOH溶液,消耗氢氧化钾的物质的量为:10mol/L×0.02L=0.2mol,根据反应KOH+Al(OH)3=KAlO2+2H2O及质量守恒定律可知n(Al)=n[Al(OH)3]=n(KOH)=0.2mol,生成0.2mol氢氧化铝消耗了0.6molKOH,则生成氢氧化镁沉淀消耗氢氧化钾的物质的量为:(0.16L-0.08L)×10mol/L-0.06mol=0.2mol,则生成氢氧化镁的物质的量为:n[Mg(OH)2)]=$\frac{1}{2}$n(KOH)=0.2mol×$\frac{1}{2}$=0.1mol,根据质量守恒定律可知合金中含有0.1molMg,含有镁的质量为:24g/mol×0.1mol=2.4g,
故答案为:2.4;
(2)加入160mL氢氧化钾溶液时,沉淀达到最大,此时溶质为硫酸钾,则n(H2SO4)=n(K2SO4)=$\frac{1}{2}$n(KOH)=$\frac{1}{2}$×(10mol/L×0.16L)=0.8mol,
则所用硫酸的物质的量浓度为:$\frac{0.8mol}{0.2L}$=4mol/L,
故答案为:4;
(3)根据以上计算可知,生成沉淀中含有0.2mol氢氧化铝、0.1mol氢氧化镁,则生成沉淀的最大值为:78g/mol×0.2mol+58g/mol×0.1mol=21.4g,即m1=21.4,
故答案为:21.4.
点评 本题考查了混合物反应的计算、镁和铝的性质,题目难度中等,明确图象曲线变化对应反应实质为解答关键,注意掌握守恒思想在化学计算中的应用方法.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na+2NH3=2NaNH2+H2↑ | B. | NH3+HCl=NH4Cl | ||
| C. | 4NH3+6NO=5N2+6H2O. | D. | 3SiH4+4NH3=Si3N4+12H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸一般要保存棕色试剂瓶中,置于阴凉处,原因是:4HNO3$\frac{\underline{\;见光或受热\;}}{\;}$2NO2↑+O2↑+2H2O | |
| B. | 配制240ml浓度为1 mol•L-1的NaOH溶液,需将NaOH固体放在烧杯中,用托盘天平称取10.00g,选用250ml的容量瓶进行配制 | |
| C. | 常温下可用铁质或铝制容器储运浓硝酸,是因为常温下二者不发生反应 | |
| D. | 铵盐在加热时都会分解产生氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 172.5 kJ/mol | B. | -172.5 kJ/mol | C. | 393.5 kJ/mol | D. | -393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2MH3(g)△H=-38.6kJ•mol-1 | |
| B. | N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H=38.6kJ•mol-1 | |
| D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既不能使炉火瞬间更旺,又不能节省燃料 | |
| B. | 虽不能使炉火瞬间更旺,但可以节省燃料 | |
| C. | 既能使炉火瞬间更旺又可以节省燃料 | |
| D. | 不能节省燃料,但能使炉火瞬间更旺 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com