
| A. | NaCl晶体 | B. | 液态HCl | C. | 熔融的KNO3 | D. | Na2SO4溶液 |
分析 在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不导电的化合物为非电解质;能够的导电的物质中存在自由移动的导电粒子,据此进行解答.
解答 解:A.氯化钠晶体不能导电,溶于水或熔融状态下能导电,属于电解质,故A错误;
B.液态HCl不能导电,溶于水能导电,属于电解质,故B错误;
C.熔融状态下的硝酸钾能够电离出钾离子和硝酸根离子,所以熔融的硝酸钾能够导电,且熔融的硝酸钾为化合物,属于电解质,故C正确;
D.硫酸钠溶液能够导电,但是硫酸钠溶液为混合物,不是电解质,故D错误;
故选C.
点评 本题考查了电解质与非电解质的判断,题目难度不大,注意掌握电解质与非电解质的概念及判断方法,明确无论电解质还是非电解质,都一定是化合物.


科目:高中化学 来源: 题型:选择题
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 水库的钢闸门连电源正极不易被腐蚀 | |
| D. | 轮船船体镶嵌锌块,船体不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 110 kJ | B. | 440 kJ | C. | 1100 kJ | D. | 2216 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示碳原子,用
表示碳原子,用  表示氧原子,用
表示氧原子,用  表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: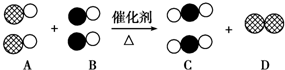
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.
A、B、C、D、M为原子序数依次增大的五种元素,A是元素周期表中原子半径最小的元素;B的一种单质在自然界中硬度最大;C、D的单质都是空气的主要成分;M位于元素周期表的第四周期第6纵行.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com