
【题目】下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中与较活泼的金属反应的离子方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)① 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
② 若用X mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为m g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L。(用含m的代数式表示)。
【答案】(1)过滤;(2)2Fe3+ +Fe = 3Fe2+;(3)Cu粉;Cu2+,Fe2+ ;(4)①MnO4- + 5Fe2+ + 8H+= Mn2++ 5Fe3++4H2O; ②0.4XY;(5)Fe3+ >Cu2+ >Mn2+ ;(6)22.4m/64。
【解析】
试题分析:(1)根据三个过程中得到的是固体和溶液,因此分离方法是过滤;
(2)根据旧合金成分,以及题意FeCl3与较活泼金属反应,金属活动顺序表,Fe比Cu活泼,因此2Fe3++Fe=3Fe2+;
(3)最后电解液中有Cu2+,所以加入的过量的还原剂为Cu;发生的反应Cu+2Fe3+ = 2Fe2++Cu2+,因此金属阳离子为Cu2+、Fe2+;
(4)①高锰酸钾溶液把Fe2+氧化成Fe3+,根据化合价的升降法进行配平,其离子反应方程式为MnO4- + 5Fe2+ + 8H+ = Mn2++ 5Fe3++4H2O;②根据得失电子数目守恒,Y × 10-3 × X × 5 = n(Fe2+) × 1,n(Fe2+) = 5XY × 10-3mol,根据铁元素守恒n(Fe2O3) = n(Fe2+)/2 = 5XY × 10-3/2mol,m(Fe2O3) = 5XY × 10-3 × 160/2g = 0.4XYg;
(5)假设金属阳离子的浓度为1mol·L-1,根据溶度积的定义,Fe(OH)3中的c3(OH-) = Ksp(Fe(OH)3)/c(Fe3+) = 4 × 10-38/1 = 4 × 10-38,Cu(OH)2中c2(OH-) = Ksp(Cu(OH)2)/c(Cu2+) = 2.2 × 10-20,Mn(OH)2中c2(OH-) = Ksp(Mn(OH)2) = 1.9 × 10-13,因此得出金属阳离子沉淀的先后顺序是:Fe3+>Cu2+>Mn2+;
(6)因为阴阳两极上收集到气体,因此分为两个过程,第一过程中:阳极:4OH--4e- = 2H2O+O2↑,阴极:Cu2++2e- = Cu,第二个过程:阳极:4OH--4e- = 2H2O+O2↑,阴极:2H++2e- = H2↑,n(Cu) = m/64mol,根据得失电子数目守恒,推出第一过程中n(O2) = m/128mol,两电极上收集到气体体积相等,设生成氢气的物质的量为xmol,因此有m/128+x/2 = x,解得x = m/64mol,因此阳极最后一种气体的体积为:22.4m/64L。


科目:高中化学 来源: 题型:
【题目】用一种试剂即可将酒精、苯酚溶液、己烯、甲苯4种无色液体区分开来,这种试剂是( )
A.溴水 B.FeCl3溶液 C.KMnO4溶液 D.金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验从海带中提取碘
①滴加稀硫酸和双氧水
②在海带中加入少量酒精,点燃使其燃烧为灰烬,在灰烬中加水搅拌;
③加四氯化碳并振荡
④过滤
⑤分液。
该实验的合理操作顺序是
A. ①③⑤②④ B. ②①③④⑤ C. ②④①③⑤ D. ③①②⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网
B. 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水
C. 配制1 mol·L-1 NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒
D. 量取25.00ml某盐酸,可以用量筒或者酸式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着吸要的应用.
(l)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJmol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJmol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H= _________;
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O.当生成H3AsO4的物质的量为0.6mol,反应中转移电子的数目为_________。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出),滴加过程中,溶液中微位浓度大小关系正确的是_________ (填字母)。
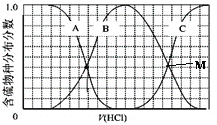
A.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
B.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
C.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
(4)某学习小组以SO2为原料,采用电化学方法制取硫酸。该小组设计的原电池原理如图2所示.写出该电池负极的电极反应式_________;
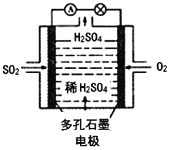
(5)难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。若转化后溶液中c(Zn2+)=3.0×10-2molL-1,则c(Cu2+)= _________ molL-1〔已知Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 ml。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml。
已知涉及的部分离子方程式为:
步骤a:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
(1)已知室温下CuI的Ksp=1. 27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。该反应的离子方程式为 。
若无该操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低” 或“不变”)。
(3)步骤b用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)指出下列能量的变化:(每空1分)
学校燃烧煤煮饭 ,用畜电池点亮灯泡 。
(2)原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
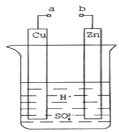
①a和b不连接时,烧杯中现象是 。
②a和b用导线连接,Cu极为原电池___极(填“正”或“负”),电极反应式为: ;溶液中H+移向_____(填“Cu”或“Zn”)极。电池总反应式为: 。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为_ ___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com