
【题目】为了充分利用铜资源,某工厂拟用黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如下:
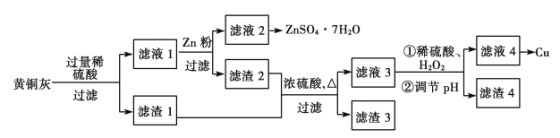
(1)滤渣1的主要成分为__________。稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的反应的离子方程式是_______________________
(2)滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是________,实验室通常用__________溶液吸收。
(3)稀硫酸通过浓硫酸稀释得到,稀释浓硫酸的正确操作方法是_____________________。过滤操作所需玻璃仪器除玻璃棒外还有_______________________
(4)用惰性电极电解滤液4可制取金属铜,若制得金属铜12.8 g,则同时阳极得到______L气体(标准状况)。
【答案】(1)Cu和SiO2 2Fe3++Cu===2Fe2++Cu2+
(2)SO2 NaOH
(3)将浓硫酸沿烧杯内壁缓缓注入蒸馏水中,同时不断地用玻璃棒搅拌 烧杯、漏斗
(4)2.24 L
【解析】根据题给信息和生产流程知黄铜灰加入过量稀硫酸发生的反应为Zn+2H+===Zn2++H2↑、ZnO+2H+===Zn2++H2O、CuO+2H+===Cu2++H2O、FeO+2H+===Fe2++H2O、Fe2O3+6H+===2Fe3++3H2O、2Fe3++Cu===2Fe2++Cu2+,过滤,滤渣1的主要成分为Cu和SiO2,滤液1为硫酸锌、硫酸铜、硫酸亚铁的混合液;向滤液1中加锌粉发生的反应为Zn+Fe2+===Fe+Zn2+、Zn+Cu2+===Cu+Zn2+,过滤,滤液2为硫酸锌溶液,滤渣2为铁、铜混合物;铁、铜和二氧化硅的混合物与浓硫酸混合加热生成硫酸铜、硫酸铁和硫酸亚铁及二氧化硫和水,过滤,滤渣3为二氧化硅,滤液3为硫酸铜、硫酸铁和硫酸亚铁的混合液,加入稀硫酸、H2O2后亚铁离子被氧化为铁离子,调节pH,铁离子转化为氢氧化铁沉淀,过滤,滤渣4为氢氧化铁,滤液4为硫酸铜溶液,处理后得铜单质。
(1)滤渣1的主要成分为Cu和SiO2。稀硫酸溶解黄铜灰过程中,可能发生多个氧化还原反应,其中没有Zn参加的氧化还原反应的离子方程式是:2Fe3++Cu===2Fe2++Cu2+。
(2)滤渣1及滤渣2用浓硫酸浸取可能产生的有毒气体是SO2,实验室通常用NaOH溶液吸收。
(3)稀释浓硫酸的正确操作方法是将浓硫酸沿烧杯内壁缓缓注入蒸馏水中,同时不断地用玻璃棒搅拌。过滤操作所需玻璃仪器除玻璃棒外还有烧杯、漏斗。
(4)滤液4为硫酸铜溶液,用惰性电极电解硫酸铜溶液发生的反应为2Cu2++2H2O2Cu+O2↑+4H+,若制得金属铜12.8 g,则同时阳极得到氧气0.1 mol,标准状况下的体积为2.24 L气体。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于蛋白质的说法中,错误的是
A.食物中的蛋白质,可以直接被人体吸收
B.氨基酸是羧酸分子中烃基上的氢原子被氨基取代的产物
C.酶本身就是蛋白质
D.多肽和蛋白质在结构上有严格区别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是
选项 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | Cu(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃和1.01×105 Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.76 kJ/mol自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ.mor1)的实验装罝如图所示。
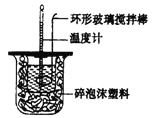
某兴趣小组的实验数值结果小于57.3 kJ/mol,原因可能是________(填字母)。
A.实验装罝保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4 溶液的温度
(2)利用氢气可以制取工业原料乙酸。己知:
A.CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ/mo1
B.C(s)+O2(g)=CO2(g) △H=-393.5kJ/mo1
C.H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是___________。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol 。
(3)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应 A: 4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
![]()
ⅱ.![]()
①写出此条件下反应A的热化学方程式是________________。
断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F 六种物质的相互转化关系如图所示(反应条件和部分副产物未标出),其中反应①是置换反应。
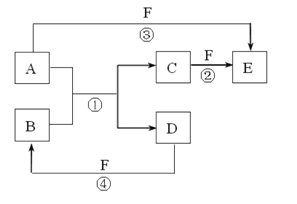
(1)若 A、D、F 都是非金属单质,且 A、D 所含元素在周期表中同一列,A、F 所含元素在周期表中同一横行,则反应①的化学方程式是 。
(2)若 A 是常见的金属单质,D、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 ;
(3)若 B、C、F 都是气态单质,且 B 有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D 相遇有白烟生成,反应③的化学方程式是 。
(4)若 A、D为单质,且 A 原子核内所含质子数是 D 的 2 倍,B 是参与大气循环的一种物质,③和④两个反应中都有红棕色气体生成,反应④的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铁粉与一定量的盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的
A. 水 B. NaOH固体 C. Na2CO3固体 D. NaNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com