
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
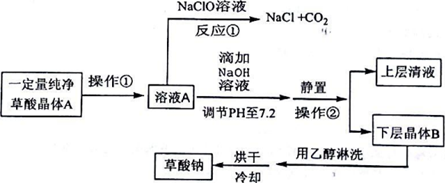
分析 一定量纯净的草酸晶体A溶解得到溶液A加入次氯酸钠溶液具有氧化性,氧化草酸为二氧化碳,反应生成氯化钠、二氧化碳和水,溶液A中滴加氢氧化钠溶液调节溶液PH至7.2,静止过滤得到下层晶体B为草酸钠晶体,草酸钠不溶于乙醇,用乙醇淋洗晶体B除去晶体表面水分减少损失,烘干冷却得到草酸钠,
(1)反应①是次氯酸钠氧化草酸生成二氧化碳,表现了草酸的还原性;
(2)氢氧化钠和草酸反应是中和反应,反应放热会增大反应速率;
(3)分析可知操作②是分离固体和溶液,利用草酸钠不溶于乙醇的性质洗涤表面的水分;
(4)发生反应为:5C2O42-+2MnO4-+16H+═2Mn2++10CO2↑+8H2O,若硫酸加入太多,会和草酸根离子反应生成草酸氢根,反应速率减小,高锰酸钾溶液具有强氧化性,不能用碱式滴定管,反应终点现象是利用高锰酸钾溶液的颜色编号指示,结合化学反应的定量关系计算.
解答 解:(1)反应①是次氯酸钠氧化草酸生成二氧化碳,反应的化学方程式为:H2C2O4+NaC1O=NaC1+2CO2↑+H2O,反应中草酸被也会为二氧化碳,表现草酸具有还原性,
故答案为:H2C2O4+NaC1O=NaC1+2CO2↑+H2O;还原;
(2)向溶液A中加入NaOH溶液,开始滴加速度要尽量快些,利用中和反应放热,升温促进反应(或增大反应速率),达到反应终点的反应化学方程式为:H2C2O4+2NaOH=Na2C2O4↓+2H2O,
故答案为:利用中和反应放热,升温促进反应(或增大反应速率);H2C2O4+2NaOH=Na2C2O4↓+2H2O;
(3)分析可知操作②是分离固体和溶液,操作②的名称是过滤,利用草酸钠不溶于乙醇的性质洗涤表面的水分,用乙醇淋洗晶体B的目的是除去晶体表面水分减少损失,
故答案为:过滤;除去晶体表面水分减少损失;
(4)用0.01000mol/L的高锰酸钾溶液滴定25.00mL某浓度的草酸钠溶液时.需要加入适量的稀硫酸,所发生反应为:5C2O42-+2MnO4-+16H+═2Mn2++10CO2↑+8H2O,若硫酸加入太多,结果会草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率,高锰酸钾溶液具有强氧化性,腐蚀橡胶管,需要盛装在酸式滴定管中,当达到反应终点时的现象是滴入最后一滴高锰酸钾溶液,溶液呈浅紫色且30s内不褪色,说明反应达到终点,反应终点测得此时消耗上述高锰酸钾溶液20.00mL,
5C2O42-+2MnO4-+16H+═2Mn2++10CO2↑+8H2O
5 2
n 0.01000mol/L×0.0200L
n=0.0005mol
25.00mL某浓度的草酸钠溶液浓度=$\frac{0.0005mol}{0.0250L}$=0.020mol/L,
故答案为:草酸根会生成草酸氢根和草酸,使溶液中草酸根离子浓度降低,减慢反应速率;酸式;溶液呈现浅紫色且30s内不褪色;0.0200.
点评 本题考查了物质制备、物质性质、氧化还原反应滴定过程分析、溶液浓度计算等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 实验次 序编号 | 盐酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
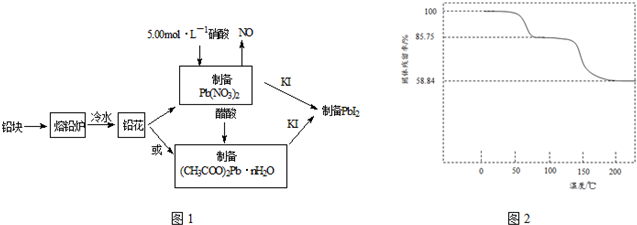
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3 饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式: PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
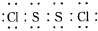 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
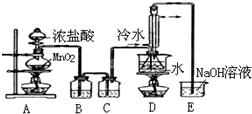
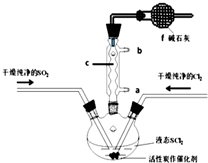 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 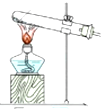 |  | 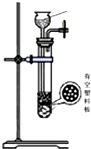 | 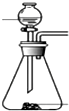 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
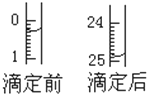 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:| 滴定序号 | 待测液体积(mL) | 所消耗KOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 25.12 | 24.62 |
| 2 | 20.00 | 0.30 | 24.90 | 24.60 |
| 3 | 20.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com