
【题目】(1)1 mol石墨转变成金刚石需要吸收1.9 kJ的热量该反应的热化学方程式是__________。
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为_________。
(3)已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
(4)向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___________。
【答案】C(石墨,s)=C(金刚石,s) △H=+1.9kJ/molC2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-2QkJ/molFeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-11 kJ·mol-1Ba2+(aq)+SO42-(aq)=BaSO4(s) ΔH=-18 kJ·mol-1
【解析】
(1)1 mol石墨转变成金刚石需要吸收1.9 kJ的热量,该反应的热化学方程式为C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol,故答案为:C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol;
(2)因生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,CaCO3的物质的量是1mol,由碳元素守恒可知,二氧化碳的物质的量也为1mol,即生成1mol二氧化碳放出的热量为Q,而完全燃烧1摩尔无水乙醇时生成2mol二氧化碳,则放出的热量为Q×2=2Q,热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-2QkJ/mol,故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-2QkJ/mol;
(3)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol,③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol,依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66kJ/mol;得到热化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g) △H=-11kJ/mol,故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g) △H=-11kJ/mol;
(4)100mL 0.4molL-1 Ba(OH)2的物质的量为0.04mol,向H2SO4溶液中加入100mL 0.4molL-1 Ba(OH)2溶液反应涉及的离子方程式有Ba2+(aq)+SO42-(aq)=BaSO4(s),H+(aq)+OH-(aq)=H2O(l),100mL 0.4molL-1 HCl的物质的量为0.04mol,反应涉及的离子方程式为H+(aq)+OH-(aq)=H20(l),根据放出的热量为2.2kJ,可知H+(aq)+OH-(aq)=H2O(l)△H=-![]() =-55kJmol-1,设Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-QkJmol-1,则0.04Q+0.08mol×55kJmol-1=5.12kJ,解之得Q=18,所以Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJmol-1。故答案为:Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJmol-1。
=-55kJmol-1,设Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-QkJmol-1,则0.04Q+0.08mol×55kJmol-1=5.12kJ,解之得Q=18,所以Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJmol-1。故答案为:Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJmol-1。


科目:高中化学 来源: 题型:
【题目】下图为H2与O2反应生成H2O(g)的能量变化示意图,下列有关叙述不正确的是

A. 1 mol H2分子断键需要吸收436 kJ的能量
B. H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C. 反应物的总能量高于生成物的总能量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是
A. 在强碱性溶液中次氯酸钠与 Fe(OH)3 反应生成 Na2FeO4: 3ClO3-+2Fe(OH)3 =2FeO42-+3Cl-+H2 O+4H+
B. 用浓盐酸与 MnO2 反应制取少量氯气:MnO2+2H++2Cl-= Mn2++Cl2↑+2H2O
C. 向 NaAlO2 溶液中通入过量 CO2 制 Al(OH)3:AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
D. 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-===3Fe3++NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是

A. a为负极、b为正极
B. 电解过程中,c电极上发生氧化反应
C. d为阳极,电极反应为:2Cl―2e-=Cl2↑
D. 电解过程中,化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
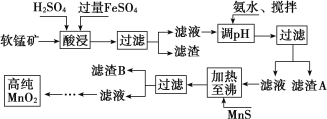
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及其化合物的说法正确的是
A.硅在自然界中以游离态和化合态两种形式存在
B.硅晶体是良好的半导体,可用于制造光导纤维
C.木材浸过水玻璃后,不易着火
D.SiO2是酸性氧化物,不与任何酸发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响产生氢气的量,可向其中加入( )
A.CH3COOK固体B.CuCl2固体C.KNO3溶液D.铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中的所有原子可能都在同一平面上的是
A.CH3(CH2)4CH3B.CH3CH2CHO
C.CH2=CHCH=CH2D.(CH3)3C-C≡C-CH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,水只做氧化剂的是
A.C+H2O=CO+H2
B.2H2O=2H2↑+O2↑
C.Na2O+H2O=2NaOH
D.CuO+H2=Cu+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com