
分析 (1)酸性氧化物指能和碱反应生成盐和水的氧化物;
(2)非电解质是在水溶液里或熔融状态下都不能导电的化合物,前提必须是化合物;
(3)水溶液中完全电离的电解质为强电解质;
(4)存在自由移动的电子,溶液或熔融状态下,含有自由移动离子的可以导电;
(5)醋酸为弱酸,不能拆;
(6)过量二氧化碳与氨水反应生成碳酸氢铵;
(7)二氧化硫溶于水生成亚硫酸,亚硫酸为二元弱酸,分步可逆电离;
(8)溶液中n(NaOH)=0.4mol,则n(NaOH):n(CO2)=0.4mol:0.3mol=4:3=1:0.75,介于2:1与1:1之间,故发生反应:CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,且NaOH、CO2无剩余,溶液中溶质为Na2CO3、NaHCO3.令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,根据钠元素守恒、碳元素守恒列方程计算a、b的值;
(9)利用少定多变法书写.
解答 解:(1)酸性氧化物指能和碱反应生成盐和水或与水反应生成对应的酸的氧化物,二氧化碳与水反应生成碳酸、二氧化硫生成亚硫酸,故答案为:②⑩;
(2)非电解质是在水溶液里或熔融状态下都不能导电的化合物,前提必须是化合物,符合条件的只有氨气,故答案为:②⑦⑩;
(3)水溶液中完全电离的电解质为强电解质,强酸、强碱、活泼金属氧化物、绝大多数盐为强电解质,故答案为:①⑤⑥;
(4)存在自由移动的电子,溶液或熔融状态下,含有自由移动离子的可以导电,故答案为:④⑥⑧⑨;
(5)酸碱中和生成醋酸钠和水,醋酸为弱酸,不能拆,离子方程式为OH-+CH3COOH=CH3COO-+H2O,故答案为:OH-+CH3COOH=CH3COO-+H2O;
(6)过量二氧化碳与氨水反应生成碳酸氢铵,离子方程式:CO2+NH3﹒H2O=NH4++HCO3-,故答案为:CO2+NH3﹒H2O=NH4++HCO3-;
(7)二氧化硫溶于水生成亚硫酸,亚硫酸为二元弱酸,分步可逆电离,电离方程式为H2SO3≒H++HSO3-;HSO3-≒H++SO32-,故答案为:H2SO3≒H++HSO3-、HSO3-≒H++SO32-;
(8)溶液中n(NaOH)=0.4mol,则n(NaOH):n(CO2)=0.4mol:0.3mol=4:3=1:0.75,介于2:1与1:1之间,故发生反应:CO2+2NaOH=Na2CO3+H2O、CO2+NaOH=NaHCO3,且NaOH、CO2无剩余,溶液中溶质为Na2CO3、NaHCO3,令溶液中Na2CO3、NaHCO3的物质的量分别为amol、bmol,则:根据钠元素守恒有:2a+b=0.4
根据碳元素守恒有:a+b=0.3
联立解得:a=0.1,b=0.2
则n(Na2CO3):n(NaHCO3)=0.1mol:0.2mol=1:2
离子方程式4OH-+3CO2=CO32-+2HCO3-+H2O,故答案为:Na2CO3和NaHCO3;4OH-+3CO2=CO32-+2HCO3-+H2O;
(9)将氢氧化钙定为1mol,含1mol钙离子和2mol氢氧根离子,需要2molt碳酸氢根离子,生成1mol碳酸钙、2mol水、1mol碳酸钠,离子反应为2HCO3-+2OH-+Ca2+=CaCO3↓+H2O+CO32-,故答案为:2HCO3-+2OH-+Ca2+=CaCO3↓+H2O+CO32-.
点评 本题考查了电解质、非电解质、强电解质、导电性的分析判断、离子反应方程式的书写,主要是概念理解应用,物质组成和性质是解题关键,掌握基础是关键,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法即可解答,题目难度不大.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
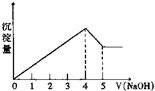 有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为( )| A. | 2:1 | B. | 4:1 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2含有的分子数为NA | |
| B. | 常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA | |
| C. | 1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用原煤脱硫技术,可减少燃煤产生的SO2 | |
| B. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| C. | 自来水厂可用氯气来杀菌消毒,因此氯气无毒 | |
| D. | 高纯度的硅单质广泛用于光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
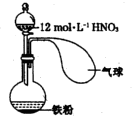 如图所示,向一定量的铁粉中加入一定体积12mol/L的浓硝酸并加热,待反应结束时,下列微粒在体系中一定大量存在的是( )
如图所示,向一定量的铁粉中加入一定体积12mol/L的浓硝酸并加热,待反应结束时,下列微粒在体系中一定大量存在的是( )| A. | ①② | B. | ①⑤ | C. | ②⑤⑥ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com