
| A. | 向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 1L2mol•L-1的FeBr2溶液中通入2.5mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 | |
| D. | 以石墨作电极电解CuCl2溶液:2Cl-+2H2O═2OH-+Cl2↑十H2↑ |
分析 A.反应生成碳酸钙、碳酸钠和水;
B.反应生成碳酸氢钙、HClO;
C.物质的量比为2:2.5=4:5,由电子守恒可知,亚铁离子全部被氧化,溴离子部分被氧化;
D.电解生成Cu和氯气.
解答 解:A.向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O,故A错误;
B.次氯酸钙溶液中通入过量二氧化碳的离子反应为ClO-+CO2+H2O═HCO3-+HClO,故B错误;
C.1L2mol•L-1的FeBr2溶液中通入2.5mol Cl2,由电子守恒可知离子反应为4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2,故C正确;
D.以石墨作电极电解CuCl2溶液的离子反应为2Cl-+Cu2+$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:解答题
 ⑦
⑦ ⑧
⑧
| 需加入的试剂 | 分 离 装 置 | |
| 1-氯丙烷(乙醇) | ||
| 乙烷(乙烯) | ||
| 苯(苯酚) | ||
| 硬脂酸钠溶液(甘油) | ||
| 溴化钠溶液(碘化钠) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z三种物质,它们之间存在如图转化关系:
有X、Y、Z三种物质,它们之间存在如图转化关系: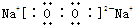 ;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.
;Y、Z两种物质相比,相同的化学键类型为离子键,当由X制取Z的上述两种途径生成Z的量相等时,转移电子数目比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3-,Cl-,K+ | B. | ClO-,Cl-,H+ | ||
| C. | NaClO,NaClO3,NaNO3 | D. | NaClO,Na2SO4,NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃--通入澄清石灰水--加溴水 | |
| B. | 点燃--罩上干燥烧杯--通入澄清石灰水 | |
| C. | 点燃--通入澄清石灰水 | |
| D. | 点燃--通入酸性KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com