
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的状态 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m2 |
| 3 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| 4 | 50.0 | 6.0 | 粉末 | 25 | t2 | 14.9 |
| 5 | 50.0 | 8.0 | 粉末 | 25 | t3 | 19.3 |
| 6 | 50.0 | 10.0 | 粉末 | 25 | t4 | m3 |
| A. | t1>70 | |
| B. | m3=19.3 | |
| C. | 实验1、实验2与实验3探究的是温度对化学反应速率的影响 | |
| D. | 无法计算出硫酸的物质的量浓度 |
分析 A.根据实验1和实验3中的反应物接触面积不同,其他条件相同进行分析;
B.硫酸的量一定,锌的质量增加,生成硫酸锌的质量增加,锌的质量与生成硫酸锌的质量成正比关系进行分析;
C.实验1和实验2的温度不同,其他条件相同,实验1和实验3的反应物接触面积不同,其他条件相同;
D.当锌的质量达到一定程度时,硫酸反应完全,根据关系式可计算出硫酸的物质的量,根据公式:c=$\frac{n}{V}$计算.
解答 解:A.实验1和实验3中的反应物接触面积不同,其他条件相同,粉末状比颗粒状的接触面积大,实验3反应速率更快,完全溶于酸的时间更短,则t 1<70,故A错误;
B.硫酸的量一定,锌的质量增加,生成硫酸锌的质量增加,
根据Zn~ZnSO4,
65g 161g
2g 4.95g≈5.0g
2g锌反应生成硫酸锌5.0g,6g锌反应生成14.9g,锌的质量与生成硫酸锌的质量成正比关系,若8g锌完全反应,
根据 Zn~ZnSO4,
65g 161g
8g m(ZnSO4)
生成的硫酸锌的质量约等于19.8g,实际生成19.3g,说明8g锌已过量,硫酸反应完全,当锌的质量为10g时,生成的硫酸锌的质量不会再增加,则m3=19.3g,故B正确;
C.实验1和实验2的温度不同,其他条件相同,是探究温度对反应速率的影响;实验1和实验3的反应物接触面积不同,其他条件相同,是探究反应物接触面积对反应速率的影响,故C错误;
D.当锌的质量达到一定程度时,硫酸反应完全,根据关系式H2SO4~ZnSO4可计算出硫酸的物质的量,硫酸锌的质量为19.3g,n(ZnSO4)=$\frac{19.3g}{161g•mo{l}^{-1}}$≈0.12mol,
根据公式计算硫酸的浓度:c=$\frac{n}{V}$=$\frac{0.12mol}{0.05L}$=2.4mol/L,故D错误;
故选:B.
点评 本题考查温度、固体接触面积对反应速率的影响,题目难度中等,题中数据较多,需要细致分析,充分考查了学生的分析、理解信息能力和灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 第一周期第ⅠA族 | B. | 第二周期第VⅡA族 | C. | 第三周期第VⅡA族 | D. | 第三周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
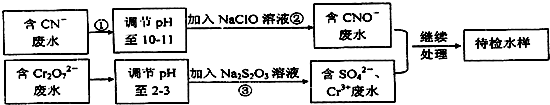
查看答案和解析>>
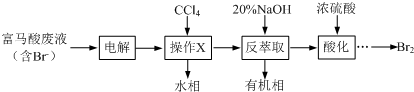
科目:高中化学 来源: 题型:解答题
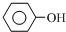 +3Br2→
+3Br2→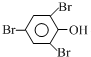 ↓+3HBr
↓+3HBr查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与H2O2 | B. | ${\;}_{6}^{12}C$与${\;}_{6}^{14}C$ | ||
| C. | 石墨与金刚石 | D. | 正丁烷与异丁烷 | ||
| E. | . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com