

 CO+H2,故答案为:C+H2O
CO+H2,故答案为:C+H2O CO+H2;
CO+H2; 2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al 2Fe+Al2O3;
2Fe+Al2O3;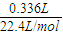 =0.015mol,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Al)=0.01mol,发生铝热反应可生成0.01molFe,故答案为:0.01.
=0.015mol,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Al)=0.01mol,发生铝热反应可生成0.01molFe,故答案为:0.01.

科目:高中化学 来源: 题型:
 物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.
物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 催化剂 |
| ||
| 催化剂 |



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正化合价与最低负化合价之和为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.
物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com