
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋 | 红色很快褪为无色 | 随溶液pH减小,NaClO的氧化能力增强 |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 苯酚和水的浊液中,加Na2CO3溶液 | 溶液变澄清 | 苯酚的酸性比碳酸强 |
| D | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | 溶液X的溶质一定属于酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加入食醋,HClO的浓度增大,漂白能力增强;
B.过氧化钠具有强氧化性;
C.苯酚与碳酸钠反应生成苯酚钠与碳酸氢钠;
D.产生无色气体,说明溶液呈酸性.
解答 解:A.加入食醋,发生强酸制取弱酸的反应原理,HClO的浓度增大,漂白能力增强,则事实与结论均合理,故A正确;
B.过氧化钠具有强氧化性,能氧化亚铁离子,该方案不能验证是否变质,应选KSCN溶液检验是否变质,故B错误;
C.因苯酚与碳酸钠反应生成苯酚钠与碳酸氢钠,所以浑浊的苯酚溶液中加入少量碳酸钠晶体,振荡后溶液变澄清,强酸反应制取弱酸,故C错误;
D.产生无色气体,说明溶液呈酸性,但不一定是酸,如硫酸氢钠,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、酸性比较及漂白性等,把握物质的性质、反应原理、实验基本操作等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的分子数之比为1:2 | |
| B. | 它们的中子数之比为5:8 | |
| C. | 它们的电子数之比为1:2 | |
| D. | 分别与1mol钠反应,生成气体的质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
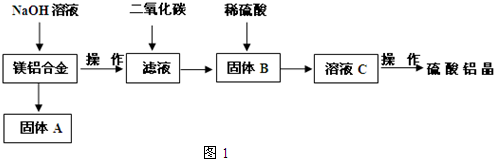
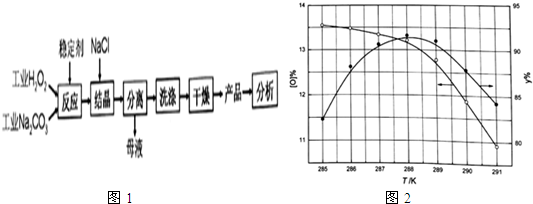
 (5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见图2,已知:失重%=$\frac{加热减少的质量}{原晶体样品的总质量}$×100%.根据图示数据计算确定每步分解的产物,写出第一阶段分解产物的化学式Al2(SO4)3.3H2O,第三阶段反应化学方程式Al2(SO4)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3SO3↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO32-、AlO2- |
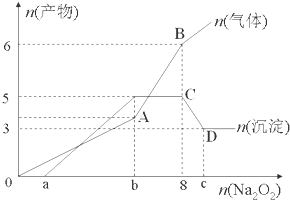
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
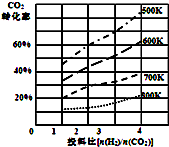 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、NO3-、Cl- | B. | Ba2+、Na+、NO3-、Cl- | ||
| C. | SO42-、SO32-、NH4+、Na+ | D. | Mg2+、Na+、Br-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0mol/L | B. | 0.24mol/L | C. | 0.19 mol/L | D. | 3 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com