
向三份均为100mL0.5mol·L-1NaHCO3溶液中,分别加入少量冰醋酸、Ca(OH)2固体、NaAlO2固体(忽略溶液体积变化),则三份溶液中c(CO32-)的变化依次为
| A.减小、减小、增大 | B.减小、增大、增大 |
| C.增大、减小、减小 | D.减小、增大、减小 |
科目:高中化学 来源: 题型:单选题
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是( )
| A.在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变 |
| B.Na2CO3溶液加水稀释后再恢复至原温度, pH和KW均减小 |
| C.室温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水电离出的c(H+)之比104:1 |
| D.25℃,若测知氨水与NH4Cl混合溶液的pH>7,则溶液中c(NH4+)>c(Cl—) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度不变,下列各项中始终保持增大趋势的是
| A.c(CH3COOH) | B.c(H+) |
C. | D.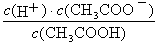 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25℃时有关弱酸的电离平衡常数:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列叙述正确的是 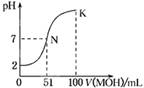
| A.HA为弱酸,MOH为强碱 |
| B.pH=7时,HA与MOH恰好完全反应 |
| C.在N点,c(A-)=c(M+) + c(MOH) |
| D.在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于电解质溶液说法正确的是 ( )
| A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| B.等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA?的电离程度大于其水解程度 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
20℃时向20mL 0.1mol·L-1醋酸溶液中不断滴入0.1mol·L-1NaOH(aq),溶液pH变化如图所示。此过程里溶液中离子浓度的关系错误的是 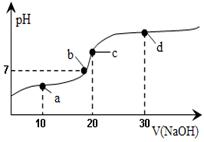
| A.a点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.b点:c(Na+) = c(CH3COO-)>c(H+) = c(OH-) |
| C.c点:c(H+) = c(CH3COOH) + c(OH-) |
| D.d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有常温下物质的量浓度均为0.1 mo/L的①氨水②NH4Cl溶液③Na2CO3溶液④NaHCO3溶液,下列说法正确的是
| A.4种溶液pH的大小顺序:①>④>③>② |
| B.等体积的①和②溶液混合后pH>7,c(NH3·H2O)>c( NH4+) |
| C.溶液①、③由水电离产生的c(OH― ):①<③ |
| D.溶液③、④等体积混合后,溶液中c(CO32-)>c(HCO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com