
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
分析 (1)依据化学反应速率的概念结合图表数据分析计算一氧化氮的反应速率,结合速率之比等于系数之比;
(2)依据平衡常数概念是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积;
(3)①根据实验目的验证温度、催化剂比表面积对化学反应速率的影响规律,则应保证浓度相同,然后相同温度时比较催化剂比表面积,相同催化剂比、表面积时比较温度;
②Ⅰ、Ⅱ温度相同,平衡不移动,但Ⅱ的速率大;Ⅲ的温度高,速率最大且平衡逆移,c(NO)增大.
解答 解:(1)前2s内的平均反应速度v(NO)=3.75×10-4mol/L•s:v(N2):v(NO)=1:2得到v(N2)=1.88×10-4mol/(L•s),
故答案为:1.875×10-4mol/(L•s);
(2)依据化学平衡三段式列式计算,
2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2
起始量(mol/L) 10×10-4 3.6×10-3 0 0
变化量(mol/L) 9×10-4 9×10-4 9×10-4 4.5×10-4
平衡量(mol/L) 1×10-4 2.7×10-3 9×10-4 4.5×10-4
反应平衡常数K=$\frac{{c}^{2}(C{O}_{2})c({N}_{2})}{{c}^{2}(CO){c}^{2}(NO)}$=$\frac{(9×1{0}^{-4})^{2}×4.5×1{0}^{-4}}{(1×1{0}^{-4})^{2}×(2.7×1{0}^{-3})^{2}}$=5000 L•mol-1;
故答案为:5000 L•mol-1;
(3)①因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;
I、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,
故答案为:
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
 ,
, .
.点评 本题综合考查反应速率、反应方向、化学平衡等知识,并注重考查了学生对实验化学的设计思路,充分体现了新课程变化,同时又注重了对高考热点的考查,是较好的一道综合题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
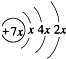 .B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
.B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了泡利原理和洪特规则.
,这样排布遵循了泡利原理和洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2固体中含有的阴离子总数为0.1NA | |
| C. | 5.6gFe与标准状况下2.24L氯气充分反应失去电子数为0.3NA | |
| D. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象 | 结论 |
| A | Cl2、SO2分别通入紫色石蕊溶液中,溶液均褪色 | 二者均有漂白性 |
| B | CO2、SO2分别通入Ba(NO3)2溶液中,均无沉淀生成 | 弱酸不能制强酸 |
| C | 向溶液中滴加盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊 | 该溶液中一定有CO32- |
| D | 将钾、钠分别放入装有煤油的试管中,二者均下沉到试管底部 | 钾、钠的密度都比煤油大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O | B. | Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3 | ||
| C. | HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O | D. | FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a一定是KOH | B. | c一定是A1C13 | C. | e一定是MgC12 | D. | b一定是KHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
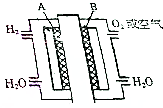 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
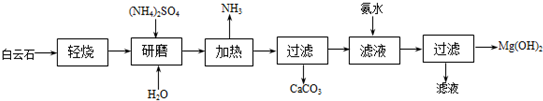
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com