
【题目】下列说法正确的是( )
A. 氧化铝不能与水反应,它不是氢氧化铝对应的氧化物
B. 因为氧化铝是金属氧化物,所以它是碱性氧化物
C. 氧化铝能跟所有的酸碱溶液反应
D. 氧化铝能跟强的酸碱溶液反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题: 
(1)d为 , 从d的水溶液中提取d的方法是 .
(2)红热的铜丝与b单质反应的现象为 .
(3)a与H2反应的化学方程式为 , b与H2反应的条件为 .
(4)由该能量变化示意图可得出的结论是同一主族,自上而下,元素的非金属性依次 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0。已知该反应在2 404 ℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为___。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志___(填字母序号)。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是__(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数_____(填“变大”“变小”或“不变”)。
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和3.0×10-3 mol·L-1,此时反应________________(填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于实验IIV的实验现象预测正确的是( ) 
A.实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验Ⅲ:从饱和食盐水中提取NaCl晶体
D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铁及其化合物下列说法正确的是
A.铁是地壳含量最高的金属元素
B.四氧化三铁是一种红棕色难溶于水的固体
C.铁与灼热水蒸气反应生成氧化铁和氢气
D.铁在氯气蒸汽中燃烧可生成FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g) △H = akJ/mol
CH3OH(g) △H = akJ/mol
已知:①CO(g)+![]() O2(g)== CO2(g) △H1=﹣283.0kJ/mol
O2(g)== CO2(g) △H1=﹣283.0kJ/mol
②H2(g)+![]() O2(g)== H2O(g)△H2=﹣241.8kJ/mol
O2(g)== H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+![]() O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a = _______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___(填字母)。
CH3OH(g)已达平衡状态的是___(填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图1所示.
的关系如图1所示.
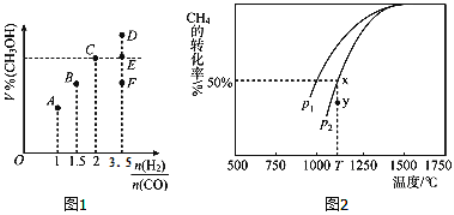
①当起始![]() =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________(选填“增大”、“减小”或“不变”);
②当![]() = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2。写出相关反应的离子方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种盐酸跟锌片反应,起始时反应速率最快的是
A.10 ℃ 20 mL 3 mol/L的盐酸 B.10 ℃ 40 mL 2 mol/L的盐酸
C.20 ℃ 20 mL 2 mol/L的盐酸 D.20 ℃ 10 mL 4 mol/L的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com