
 程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科
程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:学科 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑, (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2O4)。
N2O4)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ”“
”“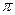 ”)。
”)。
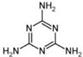 )。
)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2恰好完全转化为HNO3,则需通入O2的总体积为 升。
O2恰好完全转化为HNO3,则需通入O2的总体积为 升。 体体积均在相同条件下测定)
体体积均在相同条件下测定)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.破坏臭氧层 | B.高温下能使一些金属氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1(忽略溶液体积变化)。则a与b的关系为
的足量硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1(忽略溶液体积变化)。则a与b的关系为| A.a="b" | B.a="2b" |
| C.2a="b" | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2、NO2、Br2 | B.NO2、NO、N2 |
| C.NO2、NO、O2 | D.N2、O2、Br2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 量的Mg、Cu组成的混合物投入适量稀硝酸中,固体恰好完全溶解时收集到标准状况下0.896LNO气体,向反应后溶液中加入2mol/L NaOH溶液70mL时金属离子恰好沉淀完全。则整个过程消耗的硝酸的物质的量为 ( )
量的Mg、Cu组成的混合物投入适量稀硝酸中,固体恰好完全溶解时收集到标准状况下0.896LNO气体,向反应后溶液中加入2mol/L NaOH溶液70mL时金属离子恰好沉淀完全。则整个过程消耗的硝酸的物质的量为 ( )| A.0.18molg | B.0.16mol | C.0.14mol | D.0.12mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com