
”¾ĢāÄæ”潚ŹōøõĪŪČ¾»·¾³£¬ĘäÖ÷ŅŖĄ“Ō“ÓŚŅ±½š”¢Ė®ÄąµČ¹¤Ņµ²śÉśµÄ·ĻĖ®£¬ĆŗŗĶŹÆÓĶČ¼ÉյķĻĘųÖŠŅ²ŗ¬ÓŠæÅĮ£×“µÄøõ”£
(1)ijŠĖȤŠ”×éÄā¶ØŅŌĻĀĮ÷³Ģ£¬¶Ōŗ¬Cr3£«”¢Fe2£«µČĄė×ӵķĻĖ®½ųŠŠĪŽŗ¦»Æ“¦Ąķ”£

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁŠ“³ö¼ÓČėĖ«ŃõĖ®ŗó·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_____________________________”£
¢Ś¹żĀĖ²Ł×÷ŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠ________________________________________”£
¢Ū»īŠŌĢæµÄ×÷ÓĆŹĒ__________________________________________________”£
(2)¹¤Ņµŗ¬øõ·ĻĖ®ÖŠøõ³£ŅŌCr2O![]() ŠĪŹ½“ęŌŚ£¬æÉ°“ĻĀĮŠĮ÷³ĢĄ“³żČ„·ĻĖ®ÖŠµÄøõ”£
ŠĪŹ½“ęŌŚ£¬æÉ°“ĻĀĮŠĮ÷³ĢĄ“³żČ„·ĻĖ®ÖŠµÄøõ”£

¢ŁŠ“³ö»¹Ō³ŲÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ________________________________”£
¢ŚŹÆ»ŅĖ®“¦ĄķŗóÉś³ÉµÄ³ĮµķÓŠ______(ÓĆ»ÆѧŹ½±ķŹ¾)”£
¢ŪĻÖ“¦Ąķ1”Į102Lŗ¬øõ(¢ö)39 mg”¤L£1µÄ·ĻĖ®£¬ŠčŅŖĀĢ·Æ________g”£
”¾“š°ø”æ 2Fe2£«£«H2O2£«2H£«===2Fe3£«£«2H2O ÉÕ±”¢Ā©¶·”¢²£Į§°ō Īüø½ČܽāŌŚĖ®ÖŠµÄŌÓÖŹ£¬²¢³żČ„Ė®ÖŠµÄŅģĪ¶ Cr2O![]() £«6Fe2£«£«14H£«===2Cr3£«£«6Fe3£«£«7H2O Cr(OH)3”¢Fe(OH)3 62.55
£«6Fe2£«£«14H£«===2Cr3£«£«6Fe3£«£«7H2O Cr(OH)3”¢Fe(OH)3 62.55
”¾½āĪö”æ£Ø1£©ÓÉŅŃÖŖ½įŗĻĮ÷³Ģ£ŗŗ¬Cr3+”¢Fe2+”¢Ca2+µČĄė×ӵķĻĖ®¼ÓČė¹żŃõ»ÆĒā£¬Fe2+±»Ńõ»ÆĪŖFe3+£¬Č»ŗó¼ÓČėNaOHČÜŅŗµ÷½ŚpH=8£¬Cr3+ŗĶFe3+£¬±äĪŖCr(OH)3”¢Fe(OH)3³ĮµķĪö³ö£¬¹żĀĖŗóÓĆÄĘĄė×Ó½»»»Ź÷Ö¬³żČ„ĀĖŅŗÖŠµÄCa2+£¬×īŗóÓĆ»īŠŌĢæĪüø½Ė®ÖŠµÄŌÓÖŹ£¬²¢³żČ„Ė®ÖŠµÄŅģĪ¶£¬µĆµ½ÓĆÓŚČÕ³£Éś»īµÄ¾»»ÆĖ®”£¹Ź¢Ł¼ÓČėĖ«ŃõĖ®ŗó·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ2Fe2£«£«H2O2£«2H£«£½2Fe3£«£«2H2O£»¢Ś¹żĀĖ²Ł×÷ŠčŅŖµÄ²£Į§ŅĒĘ÷ÓŠ£ŗÉÕ±”¢Ā©¶·”¢²£Į§°ō£»¢Ū»īŠŌĢæµÄ×÷ÓĆŹĒĪüø½ČܽāŌŚĖ®ÖŠµÄŌÓÖŹ£¬²¢³żČ„Ė®ÖŠµÄŅģĪ¶”£
£Ø2£©øł¾ŻĮ÷³Ģ£¬ŗ¬Cr2O72©µÄ·ĻĖ®£¬ŌŚĖįŠŌĢõ¼žĻĀÓėĮņĖįŃĒĢś·¢ÉśŃõ»Æ»¹Ō·“Ó¦»įÉś³ÉCr3+”¢Fe3+£¬Č»ŗó¼ÓČė¹żĮæŹÆ»ŅĖ®£¬±äĪŖCr(OH)3”¢Fe(OH)3³Įµķ³żČ„”£¹Ź¢Ł»¹Ō³ŲÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCr2O72©+6Fe2++14H+=2Cr3++6Fe3++7H2O£»¢ŚŹÆ»ŅĖ®“¦ĄķŗóÉś³ÉµÄ³ĮµķÓŠCr(OH)3”¢Fe(OH)3£»¢ŪÓÉ¢ŁµĆ·“Ó¦µÄ¹ŲĻµŹ½ĪŖCr(¢ö)”«3FeSO47H2O£¬ÓɹŲĻµŹ½æÉÖŖm(FeSO47H2O)£½39 mgL£1”Į1”Į102L”Į10-3gmg-1”Ā52gmol-1”Į3”Į278gmol-1£½62.55g”£


 ѧ¶ųÓÅĻĪ½Ó½Ģ²ÄÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ѧ¶ųÓÅĻĪ½Ó½Ģ²ÄÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø Š”ѧæĪĢĆ×÷ŅµĻµĮŠ“š°ø
Š”ѧæĪĢĆ×÷ŅµĻµĮŠ“š°ø ½š²©ŹæŅ»µćČ«ĶØĻµĮŠ“š°ø
½š²©ŹæŅ»µćČ«ĶØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ£¬²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«µÄŹĒ£Ø £©
A. ±½ŅŅĻ© B. ¾ŪŅŅĻ© C. ŅŅ“¼ D. ¼×±½
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃĒĻõĖįÄĘ(NaNO2)ŹĒŅ»ÖÖÖŲŅŖµÄ¹¤ŅµŃĪ£¬Ņ²³£ÓĆÓŚÓ楹”¢ČāĄąµČŹ³Ę·µÄČ¾É«ŗĶ·ĄøÆ”£Ņ×ČÜÓŚĖ®£¬Ī¢ČÜÓŚŅŅ“¼”£Ä³»ÆѧŠĖȤŠ”×é¶ŌŃĒĻõĖįÄĘ½ųŠŠ¶ą½Ē¶ČĢ½¾æ£ŗ
I.ŃĒĻõĖįÄʵÄÖʱø

£Ø1£©ŹµŃéÖŠÓĆŗćŃ¹µĪŅŗĀ©¶·£¬Ļą±ČÓŚĘÕĶØ·ÖŅŗĀ©¶·£¬ĘäĻŌÖųÓŵćŹĒ___________”£
£Ø2£©DÖŠ³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬ŌņCÖŠÖʱøNaNO2µÄ»Æѧ·“Ó¦·½³ĢŹ½__________________”£
¢ņ.Ģ½¾æŃĒĻõĖįÄĘÓėĮņĖį·“Ó¦ĘųĢå²śĪļµÄ³É·Ö
ŅŃÖŖ£ŗ¢ŁNO£«NO2£«2OH-£½2NO2-£«2H2O ¢ŚĘųĢåŅŗ»ÆµÄĪĀ¶Č£ŗNO2 ĪŖ21”ę”¢NOĪŖ £152”ę

£Ø3£©·“Ó¦Ē°Ó¦“ņæŖµÆ»É¼Š£¬ĻČĶØČėŅ»¶ĪŹ±¼äµÄµŖĘų£¬ÄæµÄŹĒ___________________”£
£Ø4£©ĪŖĮĖ¼ģŃé×°ÖĆAÖŠÉś³ÉµÄĘųĢå²śĪļ£¬ŅĒĘ÷µÄĮ¬½ÓĖ³ŠņĪŖ£Ø°“×ó”śÓŅĮ¬½Ó£©ĪŖA”¢C”¢_______”¢_______”¢_______”£
£Ø5£©ŌŚ¹Ų±ÕµÆ»É¼Š£¬“ņæŖ·ÖŅŗĀ©¶·»īČū£¬µĪČė70£„µÄĮņĖįŗó, AÖŠ²śÉśŗģ×ŲÉ«ĘųĢ唣
¢ŁČ·ČĻAÖŠ²śÉśĘųĢåŗ¬ÓŠNO£¬ŅĄ¾ŻµÄĻÖĻóŹĒ____________________________”£
¢Ś×°ÖĆEµÄ×÷ÓĆŹĒ__________________________________________________”£
£Ø6£©Čē¹ūƻӊװÖĆC£¬¶ŌŹµŃé½įĀŪŌģ³ÉµÄÓ°ĻģŹĒ________________________”£
£Ø7£©ĶعżÉĻŹöŹµŃéĢ½¾æ¹ż³Ģ£¬æÉµĆ³ö×°ÖĆAÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČōNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A. ±ź×¼×“æöĻĀ£¬22.4 L NOÓė11.2 L O2»ģŗĻŗóĘųĢåµÄĢå»żŌ¼ĪŖ22.4 L
B. 1 L 0.2 mol”¤L£1 Al2(SO4)3ČÜŅŗÖŠµÄĄė×Ó×ÜŹżĪŖNA
C. ±ź×¼×“æöĻĀ£¬22.4 L H2OĖłŗ¬Ō×ÓøöŹż“óÓŚ3NA
D. ŗ¬4 mol HClµÄÅØŃĪĖįøś×ćĮæMnO2¼ÓČČ·“Ó¦£¬æÉÖʵĆCl2µÄ·Ö×ÓŹżĪŖNA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµē½āÖŹµÄĖ®ČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£®
£Ø1£©“×ĖįŹĒ³£¼ūµÄČõĖį£®
¢Ł “×ĖįŌŚĖ®ČÜŅŗÖŠµÄµēĄė·½³ĢŹ½ĪŖ________________________________________________£»
¢ŚĻĀĮŠ·½·ØÖŠ£¬æÉŅŌŹ¹“×ĖįĻ”ČÜŅŗÖŠCH3COOHµēĄė³Ģ¶ČŌö“óµÄŹĒ_________£ØĢī×ÖÄøŠņŗÅ£© ”£
A£®µĪ¼ÓÉŁĮæÅØŃĪĖį B£®Ī¢ČČČÜŅŗ C£®¼ÓĖ®Ļ”ŹĶ D£®¼ÓČėÉŁĮæ“×ĖįÄĘ¾§Ģå
£Ø2£©ÓĆ0.1 molL-1 NaOHČÜŅŗ·Ö±šµĪ¶ØĢå»ż¾łĪŖ20.00 mL”¢ÅØ¶Č¾łĪŖ0.1 molL-1µÄŃĪĖįŗĶ“×ĖįČÜŅŗ£¬µĆµ½µĪ¶Ø¹ż³ĢÖŠČÜŅŗpHĖę¼ÓČėNaOHČÜŅŗĢå»ż¶ų±ä»ÆµÄĮ½ĢõµĪ¶ØĒśĻß”£

¢Ł µĪ¶Ø“×ĖįµÄĒśĻߏĒ______________£ØĢī”°I”±»ņ”°¢ņ”±£©£»
¢Ś µĪ¶ØæŖŹ¼Ē°£¬ČżÖÖČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(H+)×ī“óµÄŹĒ_____________________£»
¢Ū V1ŗĶV2µÄ¹ŲĻµ£ŗV1 _____ V2£ØĢī”°£¾”±”¢”°=”±»ņ”°£¼”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCO2ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬Ņ²ŹĒÓ¦ÓĆ¹ć·ŗµÄ»Æ¹¤²śĘ·”£CO2Óė¹żŃõ»ÆÄĘ»ņ³¬Ńõ»Æ¼Ų·“Ó¦æɲśÉśŃõĘų”£
Ķź³ÉĻĀĮŠ¼ĘĖć£ŗ
£Ø1£©CO2ĶØČė°±Ė®Éś³ÉNH4HCO3£¬NH4HCO3ŗÜČŻŅ×·Ö½ā”£2.00mol NH4HCO3ĶźČ«·Ö½ā£¬·Ö½ā²śĪļ¾øÉŌļŗóµÄĢå»żĪŖ_________L(±ź×¼×“æö)”£
£Ø2£©Ä³H2ÖŠŗ¬ÓŠ2.40 molCO2£¬øĆ»ģŗĻĘųĢåĶØČė2.00 L NaOHČÜŅŗÖŠ£¬CO2±»ĶźČ«ĪüŹÕ”£Čē¹ūNaOHĶźČ«·“Ó¦£¬øĆNaOHČÜŅŗµÄÅضČĪŖ_______”£
£Ø3£©CO2ŗĶKO2ÓŠĻĀĮŠ·“Ó¦£ŗ
4KO2+2CO2”ś2K2CO3+3O2
4KO2+4CO2+2H2O”ś4KHCO3+3O2
Čō9 mol CO2ŌŚĆÜ·ā²ÕÄŚŗĶKO2·“Ó¦ŗóÉś³É9 molO2£¬Ōņ·“Ó¦Ē°ĆÜ·ā²ÕÄŚH2OµÄĮæÓ¦øĆŹĒ¶ąÉŁ£æĮŠŹ½¼ĘĖć”£
£Ø4£©¼×ĶéŗĶĖ®ÕōĘų·“Ó¦µÄ²śĪļŹĒŗĻ³É¼×“¼µÄŌĮĻ£ŗCH4+H2O![]() CO+3H2
CO+3H2
ŅŃÖŖ£ŗCO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4ĶźČ«·“Ó¦ŗóµÄ²śĪļÖŠ£¬¼ÓČė100 mol CO2ŗóŗĻ³É¼×“¼”£Čō»ńµĆ¼×“¼350 mol£¬²ŠĮōĒāĘų120 mol£¬¼ĘĖćCO2µÄ×Ŗ»ÆĀŹ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. NO2ČÜÓŚĖ®Ź±Éś³ÉĻõĖį£¬¹ŹNO2ŹĒĖįŠŌŃõ»ÆĪļ
B. Fe(NO)2ČÜŅŗÖŠµĪ¼ÓŃĪĖįČÜŅŗŃÕÉ«ÓŠĆ÷ĻŌ±ä»Æ
C. äåÕōĘūŗĶNO2¶¼ĪŖŗģ×ŲÉ«ĘųĢ壬ÓĆŹŖČóµÄµķ·Ū-KIŹŌÖ½æÉŅŌ¼ų±š
D. NO”¢COŌŚæÕĘųæÉŅŌĪČ¶Ø“ęŌŚ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖÄÖ§ŹŌ¹ÜÖŠ·ÖeŹ¢ÓŠ¹ĢĢåNaBr”¢NaCl”¢Na2SO3”¢Cu£¬·Ö±šĻņÕāĖÄÖ§ŹŌ¹ÜÖŠ¼ÓČėŹŹĮæÅØĮņĖį£¬²æ·ÖĻÖĻóČēĶ¼ĖłŹ¾£ŗ
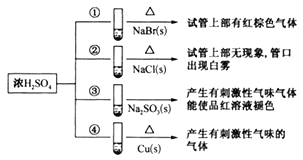
ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ£Ø £©
A. ·“Ó¦¢ŁŗĶ¢ŚµÄĻÖĻóĖµĆ÷»¹ŌŠŌ£ŗBr->Cl-
B. ÅØĮņĖįÓėNaCl²»·“Ó¦£¬°×ĪķŹĒÅØĮņĖįĪüĖ®ĖłÖĀ
C. ·“Ó¦¢ŪĻÖĻóĖµĆ÷Ńõ»ÆŠŌ£ŗÅØĮņĖį>Na2SO3
D. ·“Ó¦¢ÜµÄĻÖĻó³ż²śÉś“Ģ¼¤ŠŌĘųĪ¶µÄĘųĢåĶā£¬ČÜŅŗÖŠ»¹Īö³öĄ¶É«¾§Ģå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆĄØŗÅÄŚµÄŹŌ¼Į»ņ·ÖĄė·½·Ø£¬³żČ„ĻĀĮŠø÷ĪļÖŹÖŠÉŁĮæµÄŌÓÖŹ»ņ·ÖĄė³öĪļÖŹ£¬ÕżČ·µÄŹĒ
A. ±½ÖŠµÄäå£Øµā»Æ¼ŲČÜŅŗ£© B. ĘūÓĶÖŠµÄ±½£ØĖ®£©
C. Ćŗ½¹ÓĶÖŠµÄ±½”¢¼×±½”¢¶ž¼×±½£Ø·ÖŅŗ£© D. ¼×ĶéÖŠµÄŅŅĻ©£ØäåĖ®£©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com