
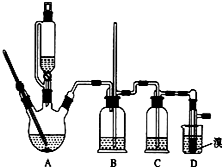
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
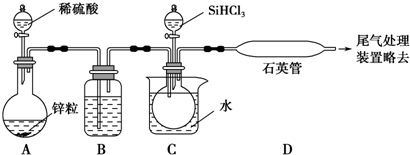
分析 实验室制备1,2-二溴乙烷:三颈烧瓶A中发生反应是乙醇在浓硫酸的作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,如果D中导气管发生堵塞事故,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可判断装置是否堵塞,装置B起缓冲作用,浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,装置C中放氢氧化钠溶液,发生反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,除去杂质气体,乙烯含有不饱和键C=C双键,能卤素单质发生加成反应,D中乙烯和溴加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,制得1,2-二溴乙烷,以此解答该题.
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,
故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,
故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,少量溴反应完全,故答案为:溴的颜色完全褪去;
(4)常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,
故答案为:b;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,
故答案为:蒸馏;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,容易堵塞导气管,
故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 本题主要考查了乙醇制备1,2-二溴乙烷,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的基本化学性质,是解答本题的关键,难度中等.


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3 ,实验员选择了一种试剂就把它们区别开来了,这种试剂是:
A.氯化钡溶液 B.氢氧化钠溶液 C.盐酸 D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
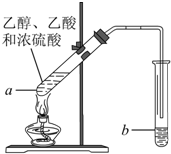 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
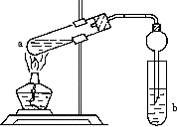 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A. | x=y=0.16 | |
| B. | 反应开始时,乙中反应速率比甲快 | |
| C. | 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(L•min) | |
| D. | 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
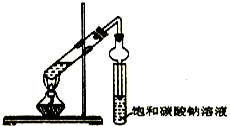 某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下列所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种物质反应,不管怎样书写化学方程式,平衡常数不变 | |
| B. | 某温度下,2L密闭容器中加入4mol A和2mol B发生反应: 3A(g)+2B(g)?4C(s)+2D(g).平衡时测得n(C)=1.6mol,反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| C. | 温度一定时,当溶液中c(Ag+)•c(Cl-)等于Ksp值时,此溶液为AgCl的饱和溶液 | |
| D. | 难溶电解质AB2饱和溶液中,c(A2+)=x mol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com