
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl一、NO3﹣、SO42﹣、CO32﹣.已知:
①五种盐均溶于水,水溶液均为无色.
②D的焰色反应呈黄色.
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性.
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀.
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失.
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;所含的阴离子相同的两种盐的化学式是 .
(2)D的化学式为 ,D溶液显碱性原因是(用离子方程式表示) .
(3)A和C的溶液反应的离子方程式是: ;E和氨水反应的离子方程式是: .
(4)若要检验B中所含的阳离子,正确的实验方法是 .
考点: 常见离子的检验方法;物质的检验和鉴别的实验方案设计.
专题: 离子反应专题.
分析: ①五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
②D的焰色反应呈黄色,则D中有Na+;
③A的溶液呈中性,B、C、E的溶液呈酸性则含有NH4+、Al3+、Ag+,D的溶液呈碱性则D中含有CO32﹣,根据阳离子可知D为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,则A、C中没有SO42﹣;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,说明C中为Ag+,则E中有Al3+;所以C中为AgNO3;
⑥把A溶液呈中性分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,则A为BaCl2;由以上分析可知E中含有Al3+,B中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则B、E中含有SO42﹣;所以B、E为(NH4)2SO4、Al2(SO4)3;结合题目进行分析.
解答: 解:①五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
②D的焰色反应呈黄色,则D中有Na+;
③A的溶液呈中性,B、C、E的溶液呈酸性则含有NH4+、Al3+、Ag+,D的溶液呈碱性则D中含有CO32﹣,根据阳离子可知D为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,则A、C中没有SO42﹣;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,说明C中为Ag+,则E中有Al3+;所以C中为AgNO3;
⑥把A溶液呈中性分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,则A为BaCl2;由以上分析可知E中含有Al3+,B中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则B、E中含有SO42﹣;所以B、E为A为BaCl2、Al2(SO4)3,
根据以上分析可知,A为BaCl2,B为A为BaCl2,C为AgNO3,D为Na2CO3,E为Al2(SO4)3,
(1)五种盐中,一定没有的阳离子是Cu2+、Fe3+;所含阴离子相同的两种盐的化学式是(NH4)2SO4、Al2(SO4)3,
故答案为:Cu2+、Fe3+;(NH4)2SO4、Al2(SO4)3;
(2)D的化学式为Na2CO3;Na2CO3溶液显碱性的原因为碳酸根离子水解生成碳酸氢根离子和氢氧根离子,反应的离子方程式为:CO32﹣+H2O⇌HCO3﹣+OH﹣,
故答案为:Na2CO3;CO32﹣+H2O⇌HCO3﹣+OH﹣;
(3)A为BaCl2,C为AgNO3,二者反应的离子方程式为:Ag++C1﹣=AgCl↓;Al2(SO4)3和氨水反应的离子方程式是Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Ag++C1﹣=AgCl↓;Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(4)检验(NH4)2SO4中所含的阳离子的方法为:取少量(NH4)2SO4于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+,
故答案为:取少量B于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+.
点评: 本题主要考查常见离子的检验方法、离子共存等知识,题目难度中等,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质推导剩余的物质,最后进行验证即可.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列有关能量转换的说法正确的是( )
A.铅蓄电池的放电过程是电能转化为化学能
B.化石燃料和植物燃料燃烧时放出的能量是化学能转化为光能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能大部分转变成化学能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
B.14g乙烯、丙烯的混合气体含有C﹣H数为2NA
C.标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用碳酸钠晶体配制1.00mol•L﹣1的Na2CO3溶液100mL,造成所配溶液浓度偏低的原因是( )
A. 暴露在空气中称量碳酸钠晶体(Na2CO3•10H2O)的时间太长
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 洗涤液移入容量瓶中时,洒出一部分
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3和AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后铁完全反应,且溶液中不存在Fe3+,同时又析出0.1mol Ag.则下列结论中不正确的是( )
A. 反应后溶液中Cu2+与Fe2+的物质的量之比为1:2
B. 氧化性:Ag+>Cu2+>Fe3+>Zn2+
C. 含Fe3+的溶液可腐蚀铜板
D. 1mol Fe可还原2mol Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
|
| A. | K+、SiO32﹣、Cl﹣、NO3﹣ | B. | H+、NH4+、Al3+、SO42﹣ |
|
| C. | Na+、S2﹣、OH﹣、SO42﹣ | D. | Na+、C6H5O﹣、CH3COO﹣、HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
|
| A. | 取a克混合物充分加热,得b克固体 |
|
| B. | 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
|
| C. | 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
|
| D. | 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
A、氯气:K+、Ba2+、SiO32-、NO3- B.氨气:K+、Na+、AlO2-、CO32-
C.二氧化硫:Na+、NH4+、SO32-、C1- D.甲醛:Ca2+、Mg2+、MnO4-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列物质:①Cu ②KMnO4 ③氯化氢 ④CO2 ⑤NaHSO4
⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀盐酸
(1)属于电解质的有 (填选项)
A. ①②④⑨ B. ②③⑤⑥ C. ④⑤⑥⑧
(2)上述物质中有物质之间在水溶液中可发生离子反应:H++OH-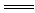 H2O,写出一个该离子反应对应的化学方程式 。
H2O,写出一个该离子反应对应的化学方程式 。
(3)②与⑨发生反应的化学方程式为: 2KMnO4 + 16HCl ══ 2KCl+2MnCl2+5Cl2↑+ 8H2O
上述反应的离子方程式 。标况下生成3.36LCl2,转移电子的数目为 ,被还原的盐酸的物质的量为 。
(4)向⑧中通入③至恰好完全反应,则⑧的导电能力的变化为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com