
| A. | 离子半径:B2->D3+ | |
| B. | 最高价氧化物对应的水化物碱性:C>D | |
| C. | 失电子能力:A>C | |
| D. | A与B可形成共价化合物:A2B、A2B2 |
分析 A、B、C、D为原子序数依次增大的短周期主族元素,A-的电子层结构与氦相同,则A为H元素,B2-和D3+的电子层结构相同,B处于第二周期、D处于第三周期,由离子电荷可知,B为O元素、D为Al,C是同周期原子半径最大的元素,原子序数大于氧、小于Al,只能处于第三周期,故C为Na,据此解答.
解答 解:A、B、C、D为原子序数依次增大的短周期主族元素,A-的电子层结构与氦相同,则A为H元素,B2-和D3+的电子层结构相同,B处于第二周期、D处于第三周期,由离子电荷可知,B为O元素、D为Al,C是同周期原子半径最大的元素,原子序数大于氧、小于Al,只能处于第三周期,故C为Na.
A.O2-和Al3+的电子层结构相同,核电荷数越大离子半径越小,故离子半径O2->Al3+,故A正确;
B.非金属性C(Na)>D(Al),故碱性:氢氧化钠>氢氧化铝,故B正确;
C.A为H,属于非金属元素,C为Na,属于金属元素,C元素失去电子能力更强,故C错误;
D.H元素与O元素可形成共价化合物:H2O、H2O2,故D正确.
故选:C.
点评 本题考查原子结构与元素周期律,推断元素是解题关键,熟练掌握短周期元素,理解元素周期律的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
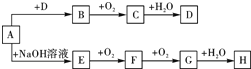 A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:
A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 | |
| B. | 二氧化硅是制造光导纤维的材料 | |
| C. | 水玻璃可用作木材防火剂 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH2=CH-CH2OH | B. | HO-CH2-CH2-CH2-COOH | ||
| C. | HNO3 | D. | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
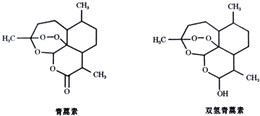
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素和双氢青蒿素不是同分异构体 | |
| C. | 青蒿素和双氢青蒿素都能发生酯化反应 | |
| D. | 青蒿素在稀硫酸催化条件下能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,滴加KSCN溶液 | 溶液变红色 | 氧化性:Fe2+>I2 |
| B | 少量的乙烯通入pH=3的溴水中 | 溴水褪色,pH基本不变 | 两者发生的加成反应 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液中一定无NH4+ |
| D | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com