
【题目】下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
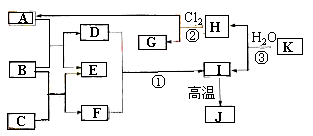
请按要求回答下列问题:
⑴写出B元素在周期表中的位置 K的化学式______________ 。
⑵反应①的离子方程式为_______________ 。
⑶将D的溶液蒸干且将所得的固体物质灼烧得到___________固体(写化学式),若要由D得溶液得到无水的D的固体,请简述其处理方法______________
⑷反应②进行的条件通常是 ,H和Cl2反应产物中有一种产物M的结构能证明G一定为正四面体结构请写出M的电子式 。
⑸J与焦炭在高温的情况下可以生成K和二氧化碳,请写出该反应的方程式____________ ;在此反应中氧化剂与还原剂的质量之比为____________
【答案】
(1)第三周期第ⅢA族;Al4C3
(2)Al3++3AlO2-+6H2O=4 Al(OH)3↓
(3)Al2O3 ;在干燥的氯化氢气流中加热蒸干
(4)光照;![]() ;
;
(5)2Al2O3+6C= Al4C3+3CO2;1:1
【解析】
试题分析:H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,则H为甲烷,结合反应②可知G为CCl4,A为HCl;J是耐高温材料且是两性氧化物,则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒知,K为Al4C3。
(1)通过以上分析知,B为Al,元素Al在元素周期表中的位置是第三周期第IIIA族,K为Al4C3,故答案为:第三周期第IIIA族;Al4C3;
(2)氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
⑶D为AlCl3,将溶液蒸干时氯化铝水解生成的氯化氢挥发,促进水解生成氢氧化铝沉淀,将氢氧化铝灼烧生成氧化铝,若要由氯化铝溶液得到无水的氯化铝固体,需要在氯化氢气流中加热蒸干,故答案为:Al2O3 ;在干燥的氯化氢气流中加热蒸干;
⑷ 反应②为甲烷与氯气的反应,需要在光照的条件下进行,二氯甲烷不存在同分异构体,可以证明四氯甲烷一定为正四面体结构,二氯甲烷的电子式为![]() ,故答案为:光照;
,故答案为:光照;![]() ;
;
⑸K为Al4C3,氯化铝与焦炭在高温的情况下可以生成Al4C3和二氧化碳,反应的方程式为2Al2O3+6C= Al4C3+3CO2,在此反应中氧化剂为碳,还原剂为碳,质量之比为1:1,故答案为:2Al2O3+6C= Al4C3+3CO2;1:1。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】碘化钠是实验室中常见的分析试剂,常用于医疗和照相业。工业上通常用水合肼(N2H4·H2O,100℃以上分解)还原法制取碘化钠,工艺流程如下:

(1)合成过程的反应产物中含有IO3-,写出合成过程的离子方程式 。
(2)还原过程必须保持反应温度在60~70℃,这个温度既能保证反应的快速进行,又能 。工业上也可以用Na2S或Fe屑还原制备碘化钠,但水合肼还原法制得的产品纯度更高,原因是 。
(3)请补充完整检验还原液中是否含有IO3-的实验方案:取适量还原液, 。实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液。
(4)测定产品中NaI含量的实验步骤如下:
a. 称取4.000g样品、溶解,在250mL容量瓶中定容;
b. 量取25.00mL待测液于锥形瓶中;
c. 用0.1000mol·L-1AgNO3溶液滴定至终点,记录消耗AgNO3溶液的体积;
d. 重复b、c操作2~3次,记录相关实验数据。
①滴定过程中,AgNO3溶液应放在 中;步骤d的目的是 。
②若用上述方法测定产品中的NaI含量偏低(忽略测定过程中的误差),其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物的核磁共振氢谱中出现三组峰的是( )
A. CH3CH2CH2CH3 B. CH3CH2CH2OH C. CH3OCH3 D. (CH3)2CHOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
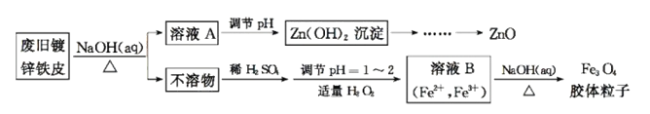
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有 。(填字母序号)
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是 。
(3)? (填“能”或“不能”)。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取 g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有 (用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将 (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,若等物质的量浓度的HA溶液和NaOH溶液混合后pH=7,下列说法合理的是
A. 反应后HA溶液一定没有剩余
B. 生成物NaA的水溶液的pH可能小于7
C. HA溶液和NaOH溶液的体积可能不相等
D. HA溶液的c(H+)和NaOH溶液的c(OH-)一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对于化学反应提出了w原子经济性。(原子节约)的新概念及要求理想的原子经济性反应是原料中的原子全部转变成所需产物不产生副产物实现零排放。下列反应为合成相应有机产物的反应原理原子利用率期望产物的总质量与生成物的总质量之比)最差的是(反应均在定条件下进行)
A.CH2=CH2 +Cl2 +Ca(OH)2→CaCl2+H2O +![]()
B.2CH3-CH=CH2+2NH3+3O2→2CH2=CH-CN+6H2O
C.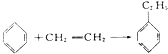
D.2CH2=CH2+O2→2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2
D.Cl2+H2O=HCl+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁:装置如图所示。
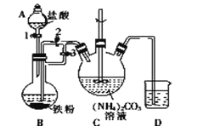
(1)B中可观察到的现象是铁粉逐渐溶解,_________________________。
将B中生成的FeCl2溶液压入装置C的操作是______________________。
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(2)加入少量铁粉的作用是___________________,反应后加入适量乳酸的作用是________________。
(3)从所得溶液中获得乳酸亚铁晶体所需的实验操作是______ _、______、洗涤、干燥。
(4)设计实验证明乳酸亚铁中含Fe2+ ____________________ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度均为0.1 mol·L-1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是 (用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c, 则它们的大小关系是 (用“=”表示)。
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是 。(用“=”表示)
(4)可逆反应2Cl2(g)+2H2O(g)![]() 4HCl(g)+O2(g) △H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g) △H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率__________; ②保持容器体积不变,加入He,则HCl的物质的量__________;③保持容器压强不变,加入He,则O2的体积分数__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com