
(18分)实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是___________ (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
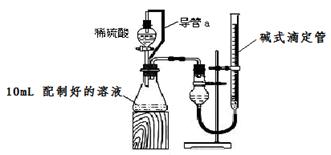
方案一:(1)D(2分)
(2)静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3—、CO32-已沉淀完全;反之,未沉淀完全(在取出澄清溶液中继续滴加Ba(OH)2溶液,如果未答出现浑浊时把取出液全部倒回原液中,不给分)(2分)
(3)玻璃棒、普通漏斗(漏斗)(2分) (4)偏小(2分)
方案二:(1)平衡压强、使液体顺利滴下;消除加入稀硫酸引起的氢气体积误差(2分)
(2)①待冷却至室温才开始读数 (1分) ②读数前左右液面相平(1分) (3)V1-V2(2分)
方案三:(1)碱式滴定管(1分) (2)由红色突变为无色,且30s不恢复(1分)(3)84.8%(2分)
解析试题分析:方案一、(1)A、CaCl2溶液只能与碳酸根反应转化为碳酸根沉淀,A不正确;B.MgSO4溶液与二者均不反应,B不正确;C.NaCl溶液与二者均不反应,C不正确;D.Ba(OH)2溶液与二者均反应,生成碳酸钡沉淀,D正确,答案选D。
(2)要证明HCO3-、CO32-已完全沉淀,则可以继续滴加氢氧化钡溶液,即正确的的实验操作是静置、澄清,在澄清溶液中继续加Ba(OH)2溶液,不浑浊,则HCO3—、CO32-已沉淀完全;反之,未沉淀完全。
(3)过滤操作所需要的玻璃仪器除烧杯外,还有玻璃棒、普通漏斗(漏斗)。
(4)如果此步中,沉淀未干燥充分就称量,则称量值偏大。由于在质量相等的条件下碳酸氢钠产生的沉淀大于碳酸钠产生的沉淀,所以如果称量值偏大,则碳酸氢钠的质量偏大,则碳酸钠的含量偏小。
方案二:(1)由于碳酸盐与酸反应产生二氧化碳气体,瓶内压强增大,所以装置中导管a的作用是平衡压强、使液体顺利滴下;消除加入稀硫酸引起的体积误差。
(2)读数是必须与外界大气压相同,因此注意事项是①待冷却至室温才开始读数,②读数前左右液面相平。
(3)碱液吸收CO2,所以前后的体积差即是二氧化碳的体积,则产生CO2的体积为(V1-V2)mL。
方案三:(1)溶液显碱性,因此应该用碱式滴定管量取。
(2)酚酞的变色范围是8.2~10.0,所以判断滴定终点的依据是由红色突变为无色,且30s不恢复。)(3)反应达到终点时,发生的离子方程式为H++CO32- =HCO3-,则根据消耗盐酸的体积可知20.00ml可知,消耗碳酸钠的物质的量是0.2000 mol/L×0.02000L=0.004mol,则原混合物中碳酸钠的物质的量是0.004mol× =0.04mol,质量是0.04mol×106g/mol=4.24g,所以碳酸钠质量分数为
=0.04mol,质量是0.04mol×106g/mol=4.24g,所以碳酸钠质量分数为 ×100%=84.8%。
×100%=84.8%。
考点:考查碳酸钠和碳酸氢钠混合物中碳酸钠含量测定的实验方案设计与评价


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为 ;铝的化合物明矾可用于净水,其原理用离子方程式解释为 。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是 。
②步骤II中涉及铝元素的离子方程式为 ;
③步骤III中能否用HCl代替CO2? (填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为 ;向该滤液中滴加少量NaOH溶液,则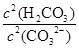 填(“变大”、“变小”或“不变”)
填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份:①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。下列说法正确的是
| A.V1=V3>V2 | B.V2>V1 =V3 | C.V1= V2>V3 | D.V1>V3>V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20=NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。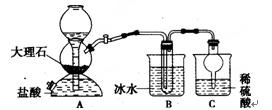
(1)A装置中所发生反应的离子方程式为 。
C装置中稀硫酸的作用为 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);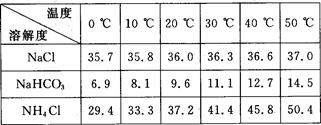
参照表中数据,请分析B装置中使用冰水的目的是 。
(3)该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出
应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_____________________________。
【实验步骤】
(1)称取10.8 g铝镁合金粉末样品,溶于体??为V物质的量浓度为4.0 mol·L-1 NaOH溶液中,充分反应。则NaOH溶液的体积V≥_________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”、“偏低”或“无影响”)。
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
【实验步骤】
(1)同学们拟选用下列实验装置完成实验: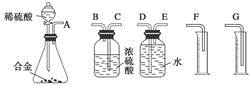
你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。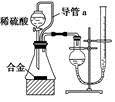
①装置中导管a的作用是_______________。
②实验前后量气管中液面读数分别为V1 mL、V2mL,则产生氢气的体积为___mL。
③若需确定产生氢气的量,还需测定的数据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
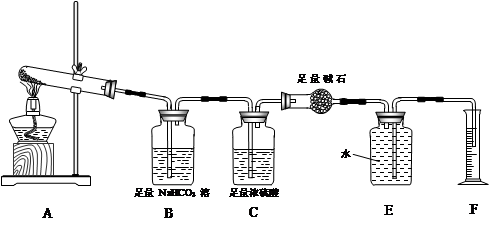
Ⅰ.某实验小组把CO2通入饱和Na2CO3溶液制取NaHCO3,装置如图所示(气密性已检验,部分夹持装置略):
(1)请结合化学平衡移动原理解释B中溶液的作用 。
(2)当D中有大量白色固体析出时,停止实验,将固体过滤、洗涤,取一定量配成样液,并加入BaCl2溶液,出现白色沉淀并有气体产生,其离子方程式是 。
Ⅱ.某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器b中可选择的试剂为(任意填一种) 。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为 。
(3)F中读取气体体积前,应向上或向下移动右管,使得左右两边液面相平,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积 (填“偏大”或“偏小”或“无影响”)。
(4)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据 (填序号)。
a.B装置实验前后质量差mg; b.F装置实验前后液面差VL
c.D装置实验前后质量差mg; d.E装置实验前后质量差mg;
(5)E装置中浓硫酸的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
|
 【实验过程】
【实验过程】查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室中用含少量CO2杂质的CO来还原铁的氧化物FexOy并证明CO能够还原FexOy,且本身被氧化为CO2,实验所提供的各种仪器和药品如下: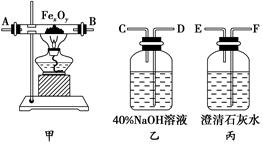
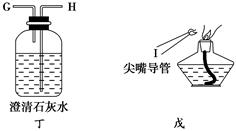
(1)实验时,上述仪器装置的正确连接顺序是(填写各接口的代号)。混合气体―→________,________接(F),(E)接________,________接________,________接________。
(2)在装置乙中发生反应的化学方程式是_______________________。
(3)在装置甲中发生反应的化学方程式是______________。
(4)丙装置中澄清石灰水的作用是_______________。
(5)经定量测定,0.4 g FexOy与CO反应生成的气体通入过量的澄清石灰水中,生成0.75 g白色沉淀,则FexOy中x值是________,y值是________。
(6)实验过程中,能说明CO能够还原FexOy的实验现象是___________。能够说明CO被氧化成CO2的实验现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
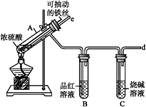
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 | C.KSCN溶液 | D.KMnO4溶液 |
 Fe(SCN)3。
Fe(SCN)3。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com