
V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:
| Y | V |
|
|
X |
|
|
| W |
Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素。V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成。下列说法正确的是( )。
A.原子半径:X>Y>V>W
B.X、W的质子数之和与最外层电子数之和的比值为2∶1
C.甲、乙混合时所生成的白烟为离子化合物,但其中含有共价键
D.少量Z的单质与过量W的单质可化合生成ZW2
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.3核素练习卷(解析版) 题型:计算题
某元素的核素为 X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
(1)计算X的质量数为多少?
(2)指出X元素在周期表中的位置。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
工业上生产硫酸的流程图如下:

请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是 。
(2)在气体进入催化反应室前需净化的原因是 。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以 ,从而提高生产效率 。
(4)工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理: 。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:实验题
由呋喃甲酸脱羧得到呋喃与丙酮在酸性条件下缩合,可得到八甲基四氧杂夸特烯。有关实验原理及流程如下;

步骤1:呋喃的制备
在圆底烧瓶中放置4.5 g呋喃甲酸(100 ℃升华,呋喃甲酸在133 ℃熔融,230~232 ℃沸腾,并在此温度下脱羧),按图安装好仪器。先大火加热使呋喃甲酸快速熔化,然后调节加热强度,并保持微沸,当呋喃甲酸脱羧反应完毕,停止加热。得无色液体呋喃(沸点:31~32 ℃,易溶于水)。

步骤2:大环化合物八甲基四氧杂夸特烯的合成
在25 mL锥形瓶中加入2.7 mL 95%乙醇和1.35 mL浓盐酸,混匀,在冰浴中冷至5 ℃以下,然后将3.3 mL丙酮和1.35 mL呋喃的混合液迅速倒入锥形瓶中,充分混匀,冰浴冷却,静置得一黄色蜡状固体。过滤,并用3 mL无水乙醇洗涤,用苯重结晶,得白色结晶八甲基四氧杂夸特烯。
(1)步骤1中用大火急速加热,其主要目的是____________________________。
(2)装置图中碱石灰的作用是__________________________________________;
无水氯化钙的作用是________________________________________________。
(3)脱羧装置中用冰盐浴的目的是_____________________________________。
(4)合成八甲基四氧杂夸特烯加入盐酸的目的是_________________________。
(5)确论产品为八甲基四氧杂夸特烯,可通过测定沸点,还可采用的检测方法有__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。
容器 | 甲 | 乙 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 |
n(SO3)/mol | 1.6 | a |
反应物的转化率 | α1 | α2 |
下列说法正确的是( )。
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率v(O2)=0.2 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
能源的开发利用与人类社会的可持续发展息息相关。
Ⅰ.已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)
ΔH1=a kJ·mol-1
CO(g)+ O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH3=c kJ·mol-1
则C的燃烧热ΔH=________ kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________(填序号)。
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:____________________________________________________________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为p0,反应过程中压强用p表示,反应过程中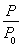 与时间t的关系如图所示。
与时间t的关系如图所示。

请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②0~2 min内,以c(N2)变化表示的平均反应速率为________。
③欲提高N2的转化率,可采取的措施有________。
A.向体系中按体积比1∶1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入氦气使压强增大
E.加入一定量的N2
(3)25 ℃时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2 mol·L-1,如果加入等体积的Na2SO4溶液,若要产生BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
下列各组离子在指定的溶液中能大量共存的是( )。
A.pH=14的溶液中:Na+、Al3+、Cl-、NO3-
B.滴入KSCN溶液显血红色的溶液中:K+、Fe2+、SO42-、Cl-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、K+、HCO3-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、Fe3+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)??B(g)+C(g) ΔH=+85.1 kJ·mol-1
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com