
【题目】化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
B. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
【答案】A
【解析】
A. 正常的雨水溶解二氧化碳,其PH为5.6,pH值小于5.6为酸雨;pH由4.68变为4.28,主要是雨水中溶解的二氧化硫生成亚硫酸,亚硫酸被氧化为硫酸,由弱酸转化为强酸,酸性增强,故 A错误;
B. 明矾净水的原理是:Al3++3H2O![]() Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水,故B正确;
Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水,故B正确;
C.三价铁离子结合水电离出的氢氧根离子生成氢氧化铁,水解是吸热过程,升温促进水解且饱和氯化铁浓度较大,有利于胶体的生成,故C正确;
D. FeCl3溶液中存在水解平衡:Fe3++3H2O![]() Fe(OH)3 + 3H+,配制FeCl3溶液时加入少量的盐酸,增加了氢离子浓度,抑制了铁离子的水解,故D正确;
Fe(OH)3 + 3H+,配制FeCl3溶液时加入少量的盐酸,增加了氢离子浓度,抑制了铁离子的水解,故D正确;
综上所述,本题选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】室温下,将等浓度等体积的弱酸HA和HB与NaHCO3反应放出CO2的体积与时间的关系如图所示,则以下说法错误的是:( )

A. 酸性:HA<HB
B. pH均为4的HA和HB溶液中和等量NaOH时,所需HA溶液体积小
C. pH均为9的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
D. 浓度均为0.1mol/L的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A的一价阴离子的电子层结构与氩原子相同,元素B的二价阳离子的电子层结构与氖原子相同。请回答:
(1)元素A离子的结构示意图为___,A的单质呈___色,检验该物质的方法是___。
(2)由A、B形成的化合物的电子式是___。
(3)与A离子具有相同电子数的一种分子是___(填名称)。
(4)A的单质与Ca(OH)2反应的化学方程式___,该反应工业上的用途是___。
(5)蓝色石蕊试纸遇到A的水溶液现象是___,请你解释这个现象___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g)达到平衡时的标志是( )
2HI(g)达到平衡时的标志是( )
A.混合气体密度恒定不变B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等D.I2在混合气体中体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列事实中,各是什么因素影响了化学反应的速率。
(1)黄铁矿煅烧时要粉碎成细小颗粒______________;
(2)夏天的食品变霉,在冬天不易发生该现象_____________;
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同__;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同_____________;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体__________;
(6)如下图,铁在海水中的腐蚀速度是②比①快______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是________。
A.c(HA)<c(A-) B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=___________mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是__________________。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=c(HCO3-).c(OH-)/c(HCO3-)=2×10-4,当溶液中c(HCO3-)∶c-(CO32-)=2∶1时,溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TMB由碳、氢、氧三种元素组成,其相对分子质量为240,是一种新型指纹检测的色原试剂,已在逐步取代强致癌物联苯胺和其他致癌性的联苯胺荷生物,应用于临床化验、法医检验、刑事侦破及环境监测等领域,某研究小组欲利用燃绕法测定TMB的分子式(氮元素转化为N2),实验装置如图所示。回答下列问题:
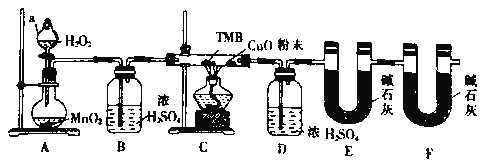
(1)实验装置两处用到装有碱石灰的干燥管,其中F处的目的是_______。仪器a的名称是__________________。
(2)将足量双氧水置于a中,圆底烧瓶中装入MnO2固体,按图连接好装置。
①A中发生反应的化学方程式为______________。
②待B、D处导管口有均匀气泡时,再点燃C处酒精灯,原因是_________________。
(3)装置C中CuO粉末的作用为_________________________。
(4)该实验_______(填“需要”或”不需要”)尾气处理,其原因是_________________。
(5)理想状态下,将4.80gTMB样品完全氧化,点燃C处酒精灯,实验结東时测得D增加3.60g,E增加14.08g,则TMB的分子式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到预期实验目的是()
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com