
| A. | 高压钠灯常用于道路的照明 | B. | 饱和石灰水用来制漂白粉 | ||
| C. | 硅晶体用作半导体材料 | D. | 金属镁常用来制造信号弹和焰火 |
科目:高中化学 来源: 题型:选择题
| A. | 制作印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | Ca(HCO3)2溶液中加足量NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| D. | KClO3溶液与浓盐酸反应:ClO3-+5Cl-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
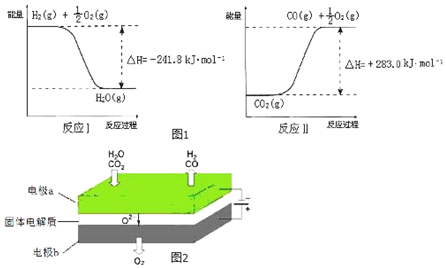
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | CCl4分子的比例模型为  其空间构型为正四面体 其空间构型为正四面体 | |
| C. | 全降解塑料  可由环氧丙烷 可由环氧丙烷  和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
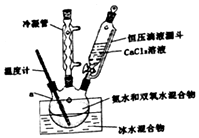 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2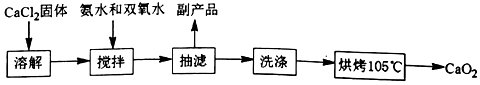
| 数据 时间 | 样品取用质量/(g) | 平均消耗体积(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高锰酸钾制取氧气 | |
| B. | 用氯酸钾和二氧化锰制取氧气 | |
| C. | 用锌和稀硫酸制取氢气 | |
| D. | 用石灰石和稀盐酸制取二氧化碳气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com