
科目:高中化学 来源: 题型:阅读理解


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?河西区二模)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.A元素的原子半径最小,与E同主族,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐X,D与E可形成淡黄色固体Y,F元素原子的最外层电子数比次外层电子数少1.请按要求回答下列问题:
(2012?河西区二模)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.A元素的原子半径最小,与E同主族,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐X,D与E可形成淡黄色固体Y,F元素原子的最外层电子数比次外层电子数少1.请按要求回答下列问题:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省原名校高三下学期第一次联考化学试卷(解析版) 题型:推断题
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素。
B元素原子的核外p电子数比s电子数少1。
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451J/mol I3=7733kJ/mol
I4=10540kJ/mol
D原子核外所有p轨道全满或半满。
E元素的主族序数与周期数的差为4。
F是前四周期中电负性最小的元素。
G在周期表的第七列。
(1)已知BA5为离子化合物,写出其电子式__________________________________。
(2)B的基态原子中能量最高的电子,其电子云在空间有①_________个伸展方向,原子轨道呈②__________________形。
(3)某同学根据上述信息,推断C的基态原子的核外电子排布图为:
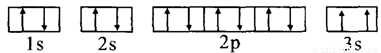
该同学所画的电子排布图违背了_________________________。
(4)G位于①_________族②________区,价电子排布式为③______________________。
(5)DE3分子中,中心原子的杂化方式为①_____________,其分子的立体构型为②_____________。
(6)F晶体的晶胞如下图所示,若设该晶胞的密度为ag·cm-3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为_____________cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是( )
A.化合物YZ3极易溶解于水
B.Z与M可以形成含18个电子的化合物
C.12g 14X中含有中子的物质的量为8mol
D.由上述四种元素组成的某盐可能受热易分解
【解析】地壳中含量最多的元素是氧,即M是O。X元素原子的最外层电子数是它的电子层数的2倍,则X是C或S,若是S,则根据X、Y、Z的电子层数之和为5,可知Y和Z的均属于第一周期,不正确,所以X只能是C。因为X、Y、M、Z四种短周期主族元素的原子半径依次减小,所以Z只能是氢元素。又因为Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,所以Y是N元素。A中是氨气,正确。B中是H2O2,正确。D中可以是NH4HCO3或(NH4)2CO3,正确。12g 14X中含有中子的物质的量为![]() ,所以答案是C。
,所以答案是C。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com