
下列事实不能用勒沙特列原理来解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.密闭容器中发生反应H2+I2=2HI,增大压强时,容器中颜色加深。
C.将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应
D.用过量空气煅烧硫铁矿可以提高硫铁矿的利用率
科目:高中化学 来源: 题型:
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是_________________________________________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O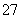 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________和________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1 K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块
A.硝酸铵 B.生石灰 C.氯化镁 D.食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比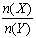 的关系如下图。改变温度和压强,生成物Z的百分含量见下表,则该反应的化学方程式可表示为
的关系如下图。改变温度和压强,生成物Z的百分含量见下表,则该反应的化学方程式可表示为
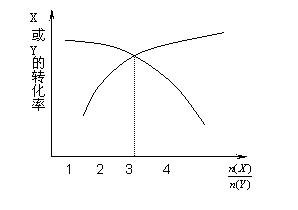
| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
A.3X(g)+Y(g) 3Z(g) ΔH<0
3Z(g) ΔH<0
B.X(g)+3Y(g) 4Z(g) ΔH>0
4Z(g) ΔH>0
C.3X(g)+Y(g) 4Z(g) ΔH>0
4Z(g) ΔH>0
D.X(g)+3Y(g) 3Z(g) ΔH<0
3Z(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应实现

 ①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
①Si(固)+3HCl(气) SiHCl3(气)+H2(气) ②SiHCl3+H2 Si+3HCl,对上述两个反应的叙述中,错误的是
A.两个反应都是置换反应 B.据反应条件无法判断反应是否吸热
C.两个反应互为可逆反应 D.两个反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,△H能正确表示物质的燃烧热的是 ( )
A.CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol
B C(s) +1/2O2(g) ==CO(g); △H=-110.5 kJ/mol
C. H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为 ,表中b c(填“<”、“=”、“>”)。
(2)20s时,N2O4的的浓度为 mol/L,0~20s内N2O4的平均反应速率为 。
(3)该反应的平衡常数表达式K= 。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施
A.增大N2O4起始浓度 B.向混合气中通入NO2
C.使用高效催化剂 D.升高温度
(6)如图是80℃时容器中N2O4浓度的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知299K时,合成氨反应3H2(g)+N2(g) 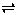 2NH3(g) △H=-92.0kJ/mol,将此温度下的1molN2和3molH2放在一个密闭容器中,在催化剂存在的时候进行反应,测得反应放出的热量为(忽略能量损失)
2NH3(g) △H=-92.0kJ/mol,将此温度下的1molN2和3molH2放在一个密闭容器中,在催化剂存在的时候进行反应,测得反应放出的热量为(忽略能量损失)
A、一定大于92.0kJ B、一定等于92.0k
C、一定小于92.0kJ D、不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com