
| A、18gH2O含有10 NA个质子 |
| B、1mol己烷含有18NA个化学键 |
| C、22.4L氨水含有NA个NH3分子 |
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |


科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、0.1 mol?L-lNaHCO3溶液中各离子浓度的大小顺序为:c( Na+)>c(HCO3-)c(HJ-)>c(OH-) |
| B、少量的CO2通人到NaCN溶液中:CN-+H2O+CO2═HCN+HCO3- |
| C、用0.1 mol?L-l NaOH溶液中和等浓度的HCN溶液和HCOOH溶液时,前者所需NaOH溶液体积大 |
| D、相同体积的0.1 mol?L-l HCOONa溶液比0.1 mol?L-l NaCN溶液所含离子总数小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):| 1 |
| 2 |
| n(H2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 具有多种同素异形体,形成的化合物种类繁多 |
| Y | 短周期主族元素中原子半径最大 |
| Z | 位于元素周期表金属与非金属元素的分界线上,最高化合价为+4 |
| W | 富集在海水中的元素,它的某些化合物常用作消毒刹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、88.0g 干冰中含有的电子数为8.0NA |
| B、常温下,11.2 L 乙烯在氧气中完全燃烧转移的电子数为6.0NA |
| C、常温下1.0 L 0.1 mol?L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA |
| D、1.2g 金刚石中含有的碳碳键数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
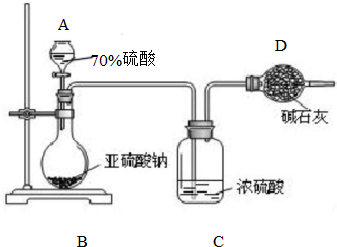 为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
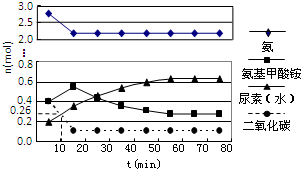 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com