
| A. | 氯化氢分子的电子式: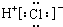 | B. | Ba(OH)2的电子式: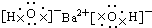 | ||
| C. | 四氯化碳的电子式: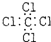 | D. | N2的结构式::N≡N: |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.Ba(OH)2是离子化合物,由Ba2+离子和OH-离子构成;
C.四氯化碳中碳原子和氯原子均满足8电子稳定结构;
D.氮气的结构式中不需要标出未成对电子.
解答 解:A.HCl为共价化合物,分子中不存在阴阳离子,正确的氯化氢分子的电子式为 ,故A错误;
,故A错误;
B.Ba(OH)2是离子化合物,由Ba2+离子和OH-离子构成,Ba(OH)2的电子式为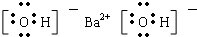 ,故B正确;
,故B正确;
C.四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为: ,故C错误;
,故C错误;
D.氮气分子中存在氮氮三键,结构式中不需要标出孤电子对,氮气的结构式为N≡N,故D错误;
故选B.
点评 本题主要考查的是电子式的书写,一般共价化合物中各元素的化合价的绝对值就是该元素原子形成的共用电子对数;原子团的电子式不仅要标出最外层电子数,而且要用“[]”括起来,在右上角标明离子所带的电荷,并要表示出两原子之间的共用电子对情况.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓盐酸、浓硫酸、浓硝酸均具有氧化性,都属于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融状态或溶于水时均能导电,都属于电解质 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能电离出离子,都属于离子化合物 | |
| D. | 金刚石、二氧化硅、碳化硅晶体中原子间均以共价键结合,都属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 该化合物中只含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
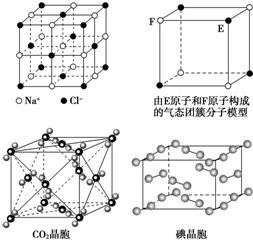
| A. | 在NaCl晶体中,距Na+最近的Cl-形成正八面体 | |
| B. | 该气态团簇分子的分子式为EF或FE | |
| C. | 在CO2 晶体中,一个CO2 分子周围有12个CO2 分子紧邻 | |
| D. | 在碘晶体中,碘分子的排列有两种不同的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23:78 | B. | 2:1 | C. | 1:1 | D. | 46:78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气 | B. | 二氧化硫 | ||
| C. | 二氧化氮和氧气 | D. | 二氧化氮和一氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
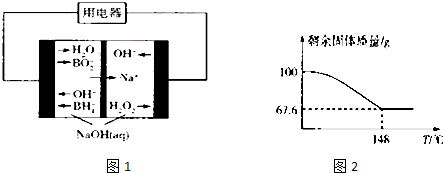
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
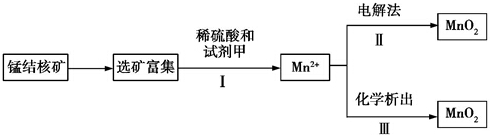
| A. | 步骤Ⅰ中的试剂甲必须具有较强的还原性 | |
| B. | 步骤Ⅲ发生反应的离子方程式为:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+ | |
| C. | 若用电解法,则MnO2将在阳极产生,电极反应式为Mn2+-2e-+2H2O═MnO2+4H+ | |
| D. | 测定步骤Ⅰ所得溶液中Mn2+的含量可采用先将Mn2+转化为Mn,然后再用0.1 mol•L-1HCl标准溶液滴定的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com