
| A、2:5 | B、1:2 |
| C、4:5 | D、2:3 |
| 1 |
| 3 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B、原子核外M层上有2个电子的X原子与原子核外N层上有2个电子的Y原子 |
| C、2p轨道上有一个未成对电子的X原子与3p轨道上有一个未成对电子的Y原子 |
| D、L 层上只有一个空p轨道的X原子与M层有一个空p轨道的Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 |
| B、今年5月18日桐庐县320国道化学品运输车侧翻造成1,1,2,2-四氯乙烷泄漏,该有机物是一种重要的有机溶剂,不溶于水且密度比水小 |
C、 如图所示的有机物分子式为C14H12O2,此有机物能与NaHCO3溶液反应放出CO2气体 |
D、化合物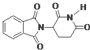 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,已知:
如图所示,已知:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、4g | C、8g | D、10g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com