
| A、向粗盐溶液中滴加盐酸和BaCl2溶液,产生白色沉淀,则说明粗盐中含有SO42- |
| B、向精盐溶液中滴加盐酸和BaCl2溶液,无明显现象,则说明精盐中不含SO42- |
| C、向蒸馏水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明蒸馏水中含有Cl- |
| D、向自来水中滴加稀HNO3和AgNO3溶液,产生白色沉淀,则说明自来水中含有Cl- |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鸡蛋白溶液中加入硫酸铵溶液变浑浊 |
| B、用福尔马林溶液浸泡动物标本 |
| C、用波尔多液(含CuSO4等)防治作物病虫害 |
| D、医院用加热法消毒医疗器械 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油的分馏、煤的气化、海水提溴过程都包含化学变化 |
| B、地沟油经处理后可作为汽车燃油,故地沟油成分是液态烃 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、乙烯和苯都能使溴水褪色,且褪色的原因相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
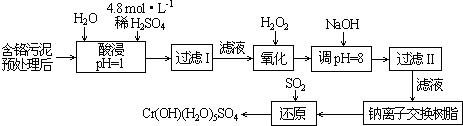
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
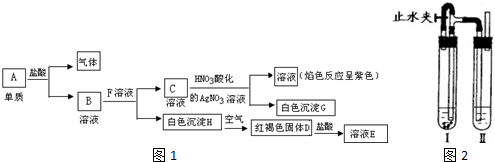
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% |
| B、配制0.1mol/L的Na2CO3溶液480mL,需要500mL容量瓶 |
| C、在标准状况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 |
| D、在2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O中,氯气是氧化产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com