
【化学与技术】
氯碱工业中曾用石棉隔膜电解槽来电解食盐水,下图即为石棉隔膜电解槽的示意图,回答下列问题:
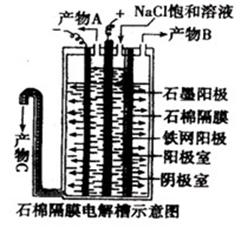
(1)产物A是 ;产物B是 ;产物C
(2)石棉隔膜能阻止 不能通过,但不能阻止 通过。
(3)粗盐水含Ca2+、Mg2+、SO42-等杂质离子,这些离子的存在除了会影响电解所得产品的纯度外,主要会 所以电解食盐水要求对粗盐水进行精制,请将精制时除去上述三种离子通常加入的化学试剂按加入的顺序依次写来 , 形成沉淀过滤后,还应加入盐酸调节pH,过滤所需要的玻璃仪器有
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A【物质结构与性质】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
B【实验化学】某化学研究性学习小组为测定果汁中Vc含量,设计并进行了以下实验。
Ⅰ 实验原理
 将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
Ⅱ 实验过程
⑴配制系列标准溶液。分别准确称量质量为1.0mg、1.5mg、2.0mg、2.5mg的标准Vc试剂,放在烧杯中溶解,加入适量的硫酸,再将溶液完全转移到100mL容量瓶中定容。
上述步骤中所用到的玻璃仪器除烧杯、容量瓶外还有 。
⑵较正分光光度计并按顺序测定标准溶液的吸光度。为了减小实验的误差,实验中使用同一个比色皿进行实验,测定下一溶液时应对比色皿进行的操作是 。测定标准溶液按浓度 (填“由大到小”或“由小到大”)的顺序进行。
⑶准确移取10.00mL待测果汁样品到100mL容量瓶中,加入适量的硫酸,再加水定容制得待测液,测定待测液的吸光度。
Ⅲ 数据记录与处理
 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | — |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
⑸原果汁样品中Vc的浓度为 mg/L
⑹实验结果与数据讨论
除使用同一个比色皿外,请再提出两个能使实验测定结果更加准确的条件控制方法 。
查看答案和解析>>
科目:高中化学 来源:北京模拟题 题型:填空题
 CH3CH2Cl+HCl
CH3CH2Cl+HCl  CH3CH2Cl
CH3CH2Cl 
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:填空题
 4CH2=CHCl+2H2O),再用氯乙烯聚合生产这种塑料,该过程的反应方程式为:______________。
4CH2=CHCl+2H2O),再用氯乙烯聚合生产这种塑料,该过程的反应方程式为:______________。查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com