
元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布。下列推测不正确的是
( )。
A.同周期元素中X的金属性最强
B.原子半径:X>Y,离子半径:X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
科目:高中化学 来源: 题型:
液态化合物AB会发生微弱的自身电离,电离方程式为ABA++B-,在不同温度下其平衡常数为K(25 ℃)=1.0×10-14,K(35 ℃)=2.1×10-14。则下列叙述正确的是 ( )。
A.c(A+)随温度升高而降低
B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25 ℃)>(35 ℃)
D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
现用98%的浓H2SO4(ρ=1.84 g·cm-3)配制浓度为0.5 mol·L-1的稀硫酸500 mL。
(1)选用的玻璃仪器除烧杯、玻璃棒外,还需__________________________。
(2)请将下列操作按正确的顺序把序号填写在横线上
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作的正确顺序为_____________________________________________________。
(3)简要回答下列问题:
①所需浓H2SO4的体积为______ mL。
②如果实验室有15 mL、20 mL、25mL的量筒,选用______ mL的量筒最好。量取时发现量筒不干净,用水洗净后直接量取将使实验最终结果______(填“偏高”、“偏低”或“无影响”)。
③在转入容量瓶前烧杯中液体应________________,否则会使浓度________(填“偏高”、“偏低”或“无影响”)。
④定容时必须使溶液凹液面最低处与刻度线相切,若俯视会使结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素性质递变情况错误的是
( )。
A.H、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家发现:具有2、8、20、28、50、82、114、126等数目的质子或中子的原子核具有特别的稳定性,并将这些偶数称为“幻数”,而具有双幻数的He、Ni、Sn、Pb等尤为稳定。根据此信息回答下列问题:
(1)写出前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号________________________________________________________________。
(2)已知氧有三种同位素O、O、O,根据上述“幻数”规律,氧的同位素中原子核最稳定的是________。
(3)根据现有元素周期律推算,R位于元素周期表的第________周期第________族,核稳定性R__________R(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种重要的能源,含有硫元素,燃烧时会生成SO2。下列说法正确的是
( )。
A.煤是含硫化合物
B.煤是一种可再生能源
C.在水吸收SO2的过程中只发生物理变化
D.SO2是酸性氧化物,被云雾吸收后可转化成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
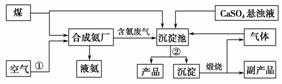
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O激光TiO22H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-===2H2O
B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com