
| A、X和其他三种元素均可形成至少2种二元化合物 |
| B、W和X、Z两种元素分别形成的二元化合物中,均有直线形分子 |
| C、W、X和Y三种元素可以形成其水溶液呈碱性的化合物 |
| D、Z和其他三种元素形成的二元化合物,其水溶液均呈酸性 |


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验现象及操作、物质的用途 | 解 释 | |
| A | 在一定浓度的乙酸溶液中加入少量乙酸钠固体,溶液pH增大 | 只是乙酸根的水解所致 |
| B | 取少量某溶液滴加氯化钡溶液,生成白色沉淀 | 该溶液中一定含有SO42- |
| C | 用铁、铝的容器来盛装冷浓硫酸或硝酸 | 铁、铝在其中表面被钝化 |
| D | 向氯化铝溶液中加入过量浓氨水,生成白色沉淀 | 氢氧化铝不溶于碱溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、在常温常压下,1.7g NH3含有的原子数为0.4NA |
| C、标准状况下,11.2L水中含有的原子数是1.5NA |
| D、0.2mol?L-1的Na2SO4溶液中含Na+数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通入醋酸溶液中:CH3COOH+NH3=CH3COONH4 |
| B、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C、氢氧化钡和稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、将钠加入水中:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2 |
| B、HCl |
| C、Na2SO4 |
| D、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
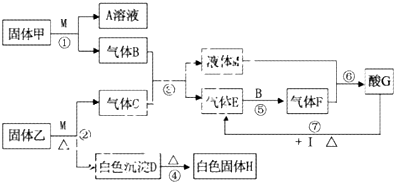
查看答案和解析>>
科目:高中化学 来源: 题型:
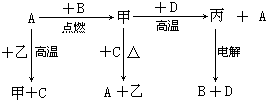
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数一定为2NA |
| B、14g分子式为CnH2n的烯烃中含有的C=C的数目,一定为NA/n |
| C、71g氯气通入足量水中,反应中转移的电子总数为NA |
| D、7.5gSiO2晶体中含有的硅氧键数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com