
化学反应a A + b B = d D + e E,已知40克A和21克B恰好完全反应生成28克D,则B、E两种物质的摩尔质量之比是
A. 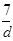 ∶
∶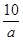 B.
B. 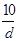 ∶
∶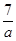 C.
C.  ∶
∶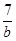 D.
D. 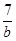 ∶
∶
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:

 的物质,该物质是一种香料.
的物质,该物质是一种香料.


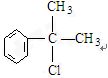





 的水解产物
的水解产物 不能经氧化反应⑥而得到产品(或A中
不能经氧化反应⑥而得到产品(或A中 的水解产物
的水解产物 中的-OH不在链端,不能氧化成-CHO)
中的-OH不在链端,不能氧化成-CHO) 的水解产物
的水解产物 不能经氧化反应⑥而得到产品(或A中
不能经氧化反应⑥而得到产品(或A中 的水解产物
的水解产物 中的-OH不在链端,不能氧化成-CHO)
中的-OH不在链端,不能氧化成-CHO)

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
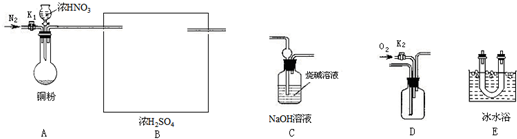
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | A的基态原子最外层电子排布式为2S22P3 |
| B | B是地壳中含量最高的元素 |
| C | C+与B的简单离子的电子层结构相同 |
| D | D的一种核素的质量数为64,中子数为35 |
| E、F | E、F既同周期又同族,且原子序数F比E多2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com