
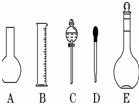
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |


科目:高中化学 来源: 题型:
| A、1molFe分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子数均为3NA |
| B、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、标准状况下,22.4LH2O的分子数约为NA个 |
| D、电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、江河入海口处形成三角洲 |
| B、不同血型的人不能相互输血 |
| C、在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 |
| D、清晨的阳光穿过茂密林木枝叶所产生的美丽景象(美丽的光线) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、置换反应、氧化还原反应、化学反应 |
| B、H2O、电解质、化合物 |
| C、胶体、溶液、混合物 |
| D、Fe3O4、金属氧化物、氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| cMg2+ |
| cCu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
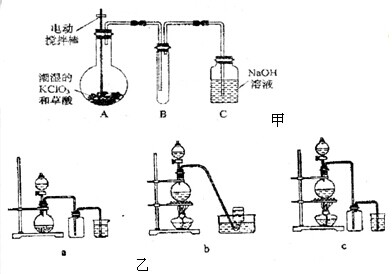
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+1 | B、+2 | C、+3 | D、+4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com