
| A. | Na+、Al3+、NO3-、SO42- | B. | K+、Na+、CO32-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、Mg2+、I-、NO3- |
分析 无色溶液中不存在Cu2+、Fe2+、Fe3+、MnO4-等有色离子,酸性溶液中存在大量氢离子,
A.四种离子之间不反应,都不与氢离子反应,且为无色溶液;
B.碳酸根离子与酸性溶液中的氢离子反应;
C.高锰酸根离子为有色离子,不满足溶液无色的条件;
D.酸性条件下,硝酸根离子能够氧化碘离子.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.Na+、Al3+、NO3-、SO42-之间不发生反应,都不与氢离子反应,且都是无色离子,在溶液中能够大量共存,故A正确;
B.CO32-与氢离子反应,在溶液中不能大量共存,故B错误;
C.MnO4-为有色离子,不满足溶液无色的要求,故C错误;
D.I-、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.


科目:高中化学 来源: 题型:解答题
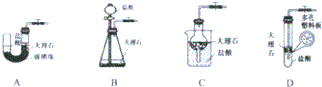 硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.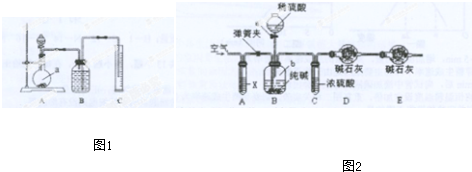
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积分数为95%的酒精通常作为医用酒精 | |
| B. | 石油的分馏、煤的气化、海水的提镁都包含化学变化 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
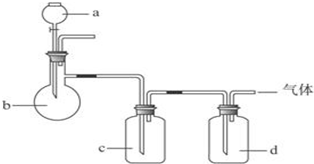
| 选项 | 气体 | a | b | c | d |
| A | SO2 | 硫酸 | 亚硫酸钠 | 浓硫酸 | NaOH溶液 |
| B | NH3 | 浓氨水 | 消石灰 | 浓硫酸 | H2O |
| C | O2 | 双氧水 | MnO2 | H2O | 浓硫酸 |
| D | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
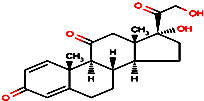 2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )| A. | 分子式为C21H22O5 | |
| B. | 属于芳香族化合物 | |
| C. | 1mol该物质最多能与5molH2发生加成反应 | |
| D. | 该物质能发生加成、取代、氧化、水解等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com