
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
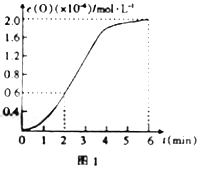
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
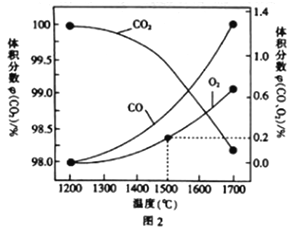
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
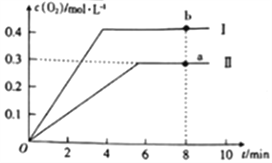
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
【答案】 0.84g -33.5 < 3×10-7mol/(L·min) AC 3.2×10-8mol/L 升温 <
【解析】(1) CO2与过氧化钠反应生成碳酸钠和氧气,根据反应规律分析可知固体质量增加量相当于增加CO的量;CO2与过氧化钠反应生成氧气,氧气再与0.01molCO电火花点燃生成0.01 molCO2,也就是相当于0.03 molCO2与过氧化钠反应,固体增加的量为0.03molCO的量,质量为0.03×28=0.84g;正确答案:0.84g。
(2)已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,O2(g)==2O(g) △H=499.0kJ/mol;根据盖斯定律可知,两个方程相加除以2即可得到CO(g)+O2(g)![]() CO2(g)+O(g)△H=-33.5 kJ/mol;正确答案:-33.5。
CO2(g)+O(g)△H=-33.5 kJ/mol;正确答案:-33.5。
②某时刻该反应体系中各物质浓度满足c(CO)·c(O2)=c(CO2) ·c(O),则QC= c(CO2) ×c(O)/ c(CO)×c(O2)=1>0.4, 则反应向左进行, 则此时v(正) <v(逆);正确答案:<。
③2min内O的浓度增大0.6×10-6mol/L,则二氧化碳减小0.6×10-6mol/L,则v(CO2)= 0.6×10-6/2=3×10-7 mol/(L·min);正确答案: 3×10-7 mol/(L·min)。
(3) ①CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B错误;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C正确;D.单位时间内消耗CO的浓度始终等于生成CO2的浓度,反应速率同向,不能判定反应达到平衡状态,D错误;正确答案AC。
②设生成的氧气为xmol,![]()
![]()
起始量![]() 00
00
转化量![]()
![]() x
x
平衡量![]() 2xx,
2xx,
平衡时,氧气的体积分数为0.2,则![]() ,则
,则![]() ,则
,则![]() ,
,![]() ,
,![]() ,
,
则![]() ;正确答案:
;正确答案:![]() 。
。
③若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且氧气的浓度增大,平衡正向进行,改变条件是升温;a、b两点后,a点温度小于b点,所以用CO浓度变化表示的反应速率关系为va(CO) <vb(CO);正确答案:升温;<。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示虚线内字母表示相应元素,而A~C表示大分子物质,a~d表示小分子物质,其中a~c是相应大分子的基本组成单位.回答以下问题:

(1)图中a是________,与A为同类化合物,属于动物细胞中储能物质的是_______。
(2)在人体细胞中物质b的种类约为______种,其中人体细胞中不能合成、需要从食物中获取的b叫做__________________。某些B分子有免疫功能,例如____________。
(3)d指的是________;除此之外,固醇类物质还包括的是___________________。
(4)图中c是____________,C分子中含有四种碱基,即____________________。
(5)从化学组成成分上看,与HIV病毒最相似的一种细胞器是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一容积固定的密闭反应器,中间有一个可自由移动的导热的隔板将容器分成甲、乙两部分,分别发生下列两个可逆反应:

甲:a(g)+b(g)![]() 2c(g) ΔH1<0、乙: x(g)+3y(g)
2c(g) ΔH1<0、乙: x(g)+3y(g)![]() 2z(g) ΔH2>0
2z(g) ΔH2>0
起初甲、乙均达到反应平衡后隔板位于正中间,然后进行相关操作后,下列叙述错误的是
A. 在反应器恒温下,向乙中通入z气体,c的物质的量浓度增大
B. 在反应器恒温下,向甲中通入惰性气体,乙中x、y的转化率增大
C. 在反应器绝热下,向乙中通入z气体,反应器中温度升高
D. 在反应器绝热下,向甲中通入惰性气体,c的物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列不发生反应的一组物质是( ) ①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱 ⑤铁与液氧 ⑥一氧化氮与氧气 ⑦硅与氧气.
A.①②③⑥
B.②③⑤⑥
C.①④⑤⑦
D.①②③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3S+6KOH ![]() 2K2S+K2SO3+3H2O,下列说法正确的是
2K2S+K2SO3+3H2O,下列说法正确的是
A. S是氧化剂,KOH是还原剂 B. 若3mol硫完全反应,则反应中共转移了4mol电子 C. 还原剂与氧化剂的质量比是2:1 D. 氧化产物和还原产物的物质的量之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com