
(10分)化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1。则:
①A+B→C+D表示的离子方程式为 。
②标准状况下,若2.24L的D被50mL 1mol/L硫酸吸收,则所得溶液中各离子浓度从大到小的顺序为____ 。
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应。则:
①A+B→C+D表示的化学方程式为 。
②D与NaOH溶液反应的化学方程式为___ 。
③若将B溶于盐酸后,再加入足量NaOH溶液可观察到的现象为 。
(1)①NH4++ OH-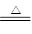 NH3↑+ H2O ② c(NH4+) > c(SO42-) > c(H+) >
c(OH-)
NH3↑+ H2O ② c(NH4+) > c(SO42-) > c(H+) >
c(OH-)
(2)① 2Al +3 FeO 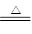 3 Fe + Al2O3
②Al2O3
+ 2NaOH == 2NaAlO2 + H2O
3 Fe + Al2O3
②Al2O3
+ 2NaOH == 2NaAlO2 + H2O
③溶液中有白色沉淀生成,白色沉淀迅速变成灰绿色,最终变成红褐色。
【解析】(1)①常见的10电子微粒是He、HF、H2O、NH3、CH4、Na+、Mg2+、Al3+、
OH-、NH4+、H3O+等。所以根据题意可知,符合条件的方程式为NH4++
OH-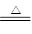 NH3↑+
NH3↑+
H2O。
②氨气是0.1mol,硫酸是0.05mol,所以二者反应生成(NH4)2SO4,(NH4)2SO4水解显酸性,所以;离子浓度大小顺序是 c(NH4+) > c(SO42-) > c(H+) > c(OH-)。
(2)①A、C为生活中常见的金属单质,B、D为两种氧化物,因此该反应应该是铝热反应,D是金属铝,B是铁。又因为B、D两种氧化物的摩尔质量比为12:17,所以B的氧化物是氧化亚铁,则方程式为 2Al +3 FeO 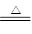 3 Fe + Al2O3。
3 Fe + Al2O3。
②氧化铝是两性氧化物,和氢氧化钠溶液反应的方程式为Al2O3 + 2NaOH == 2NaAlO2 + H2O。
③铁和盐酸反应生成氯化亚铁,因此加入氢氧化钠溶液后的现象是溶液中有白色沉淀生成,白色沉淀迅速变成灰绿色,最终变成红褐色。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届黑龙江省集贤县第一中学高三上学期期末考试化学试卷(带解析) 题型:填空题
(12分)化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1.
则:①A+B→C+D表示的离子方程式为 。
②标准状况下,若2.24L的D被100mL 2mol/L盐酸吸收,则所得溶液中各离子浓度从大到小的顺序为_ ___.
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应.
则:①A+B→C+D表示的化学方程式为 .
②D与NaOH溶液反应的化学方程式为___ _.
③工业上,将B、D按一定的量溶于盐酸后,继续通入气体Z,再加入NaOH溶液调节pH可得高效净水剂(化学式为CA(OH)aCl6-n ),则气体Z的作用是__ __,B、D的最佳物质的量之比是___ _.
④工业上,通常第一步先用C与过量稀硫酸作用得溶液X:第二步再往溶液X中加入亚硝酸钠来制备C(OH)SO4,同时有气体NO生成,写出第二步反应的化学方程式为__ __。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1.
则:①A+B→C+D表示的离子方程式为 。
②标准状况下,若2.24L的D被100mL 2mol/L盐酸吸收,则所得溶液中各离子浓度从大到小的顺序为_ ___.
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应.
则:①A+B→C+D表示的化学方程式为 .
②D与NaOH溶液反应的化学方程式为___ _.
③工业上,将B、D按一定的量溶于盐酸后,继续通入气体Z,再加入NaOH溶液调节pH可得高效净水剂(化学式为CA(OH)aCl6-n ),则气体Z的作用是__ __,B、D的最佳物质的量之比是___ _.
④工业上,通常第一步先用C与过量稀硫酸作用得溶液X:第二步再往溶液X中加入亚硝酸钠来制备C(OH)SO4,同时有气体NO生成,写出第二步反应的化学方程式为__ __。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com