
分析 (1)根据密度与摩尔质量成正比计算出该气态烃的相对分子质量,然后根据C、H的质量分数确定其分子式;
(2)该烃能使酸性高锰酸钾溶液或溴水褪色,说明分子中含有碳碳双键;其核磁共振氢谱图中显示有三组吸收峰,说明其分子中含有三种等效氢原子,据此确定其结构简式.
解答 解:(1)经测定该气态烃的密度是H2的28倍,根据密度与摩尔质量成正比可知该烃的摩尔质量质量为:2g/mol×28=56g/mol,该气态烃的相对分子质量为56,该气态烃含C 85.7%,含H 14.3%,则该烃分子中含有C、H原子数分别为:N(C)=$\frac{56×85.7%}{12}$=4、N(H)=$\frac{56-12×4}{1}$=8,
所以该烃的分子式为C4H8,
答:该烃的分子式为C4H8;
(2)该烃的分子式为C4H8,该烃能使酸性高锰酸钾溶液或溴水褪色,说明其分子中含有碳碳双键,为丁烯,丁烯的同分异构体有:CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,
该烃核磁共振氢谱图中显示有三组吸收峰,说明其分子中含有三种等效氢原子,满足条件的丁烯为CH2=CHCH2CH3,
答:满足条件的丁烯的结构简式为CH2=CHCH2CH3.
点评 本题考查了有机物分子式、结构简式的确定,题目难度不大,明确相对密度与摩尔质量之间的关系为解答关键,注意掌握常见有机物结构与性质,试题有利于培养学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
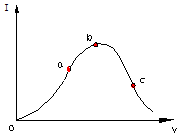 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mn2+的还原性弱于H2O2 | |
| B. | MnO4-是氧化剂,O2是氧化产物 | |
| C. | 生成lmol O2时,转移4 mol电子 | |
| D. | 离子方程式中按物质顺序的化学计量数是2、5、6、2、5、8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶使用前经蒸馏水清洗后没有干燥 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 俯视确定凹液面与刻度线相切 | |
| D. | 用敞口容器称量NaOH且时间过长 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢笔的笔头不易被氧化,抗腐蚀性能好 | |
| B. | 铱金笔的耐磨性能比钢笔好 | |
| C. | 金笔的笔头和笔尖都是用纯金制成的 | |
| D. | 金笔经久耐磨,是一种很理想的硬笔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应量取的浓盐酸的体积是10.0mL | |
| B. | 若开始时洁净的容量瓶中有少许蒸馏水,对实验没有影响 | |
| C. | 量取浓盐酸时,因浓盐酸有挥发性,所以要多量取lmL浓盐酸 | |
| D. | 定容摇匀后,发现液面低于刻度线,应立即加少量蒸馏水补至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是
的化合物与 CH2=CH2 一样,在一定条件下可聚合成高分子化合物.广泛用作 农用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化学反应方程式是 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com