
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
分析 (1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;
(2)Ge原子半径大,难以通过“肩并肩”方式形成π键;
(3)锗的卤化物都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;
(4)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(5)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体;
(6)①D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,过面心B、C及上底面面心原子的平面且平行侧面将晶胞2等分,同理过D原子的且平衡侧面的平面将半个晶胞2等等份可知D处于到各个面的$\frac{1}{4}$处;
②根据均摊法计算晶胞中Ge原子数目,结合阿伏伽德罗常数表示出晶胞的质量,再根据ρ=$\frac{m}{v}$计算晶胞密度.
解答 解:(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,在最外层的4s能级上2个电子为成对电子,4p轨道中2个电子分别处以不同的轨道内,有2轨道未成对电子,
故答案为:3d104s24p2;2;
(2)虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但考虑Ge的原子半径大,难以通过“肩并肩”方式形成π键,所以Ge原子之间难以形成双键或叁键,
故答案为:Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键;
(3)锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故沸点:GeCl4<GeBr4<GeI4,
故答案为:GeCl4、GeBr4、GeI4的熔、沸点依次增高;原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强;
(4)元素非金属性:Zn<Ge<O,元素的非金属性越强,吸引电子的能力越强,元素的电负性越大,故电负性:O>Ge>Zn,
故答案为:O>Ge>Zn;
(5)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体,Ge原子之间形成共价键,Ge原子杂化轨道数目为4,采取sp3杂化,
故答案为:sp3;共价键;
(6)①D与周围4个原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,过面心B、C及上底面面心原子的平面且平行侧面将晶胞2等分,同理过D原子的且平衡侧面的平面将半个晶胞再2等份,可知D处于到各个面的$\frac{1}{4}$处,则D原子的坐标参数为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$),
故答案为:($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$);
②晶胞中Ge原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,结合阿伏伽德罗常数,可知出晶胞的质量为$\frac{8×73g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$,晶胞参数a=565.76pm,
其密度为$\frac{8×73g/mol}{6.02×1{0}^{23}mo{l}^{-1}}$÷(565.76×10-10cm)3=$\frac{8×73}{6.02×{{565.76}^{3}}}×{{10}^{7}}$,
故答案为:$\frac{8×73}{6.02×{{565.76}^{3}}}×{{10}^{7}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、晶体类型与性质、电负性、杂化方式、晶胞计算等,(6)中晶胞计算为易错点、难点,需要学生具备一定的空间想象与数学计算能力,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和 NO2(g)的生成速率相同 | D. | SO3 (g)和 NO(g)的浓度比为 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
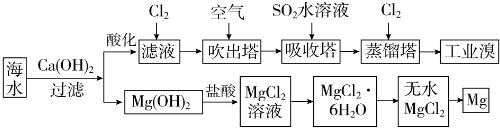
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 1mol (NH4)2Fe(SO4)2•6H2O晶体中含有离子总数为5NA | |
| C. | 常温常压下,2.24 L SO2和O2的混合气体中含有的氧原子总数为0.2 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中含的CO32-和HCO3-总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2所含的分子数目为NA | |
| B. | 1 mol H2O含有的H2O分子数目为NA | |
| C. | 1 mol H2O含有的氢原子数目为NA | |
| D. | 0.5NA个O2分子的物质的量是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶颗粒 | B. | 无水碳酸钠 | C. | 玻璃珠 | D. | 晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com