
分析 (1)②中Fe元素的化合价降低;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气;
(4)金属铁能被磁铁吸引,可以用来检验金属铁的存在.
解答 解:(1)②中Fe元素的化合价降低,则,②中的Fe3+作氧化剂,故答案为:氧化;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高,所以维生素C作还原剂,具有还原性,故答案为:还原;还原;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气,该离子反应为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑;
(4)证明该麦片中含有微量的颗粒细小的还原铁粉可以:取少量麦片于烧杯中加水溶解并过滤,有微量的细小颗能被磁铁吸引,故答案为:取少量麦片于烧杯中加水溶解并过滤,有微量的细小颗能被磁铁吸引.
点评 本题考查氧化还原反应,为高考常考考点,明确反应中元素的化合价变化是解答的关键,侧重基本概念的考查,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:选择题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | H+ | D. | S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应放出的热量为0.08akJ | |
| B. | 平衡时H2O的转化率为CO转化率的一半 | |
| C. | 若改变条件,K增大则压强增大 | |
| D. | 将容器的体积压缩为1L,该平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
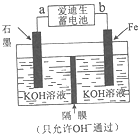 中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:
中国是世界上第一钢铁生产大国,近两年钢铁行业形式急转直下,不少钢铁企业陷入全面亏损,2015年,钢铁年产量出现34年来的首次下降.原因就是因为高炉炼铁技术低级落后,不能生产高附加值产品.请根据所学知识回答下列问题:| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
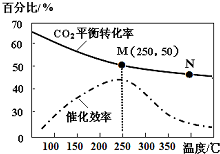 综合利用CO2、CO对构建低碳社会有重要意义.
综合利用CO2、CO对构建低碳社会有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,反应程度越大 | B. | K越大,反应程度越小 | ||
| C. | K的大小与反应程度无关 | D. | 升高温度,K增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com