
| A. | CH3COOH | B. | OH- | C. | Fe3+ | D. | 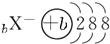 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是一种国际基本物理量 | |
| B. | 1 mol氢的质量为1g | |
| C. | 在同温同压下,相同体积的任何气体单质所含分子数相同 | |
| D. | 标准状况下气体摩尔体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-一定不能大量存在于该溶液中 | |
| B. | NH4+一定不能大量存在于该溶液中 | |
| C. | 该溶液的pH一定为12 | |
| D. | 该溶液中c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与醋酸溶液反应:CaCO3+2H +═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水和盐酸反应:OH-+H+═H2O | |
| C. | 用Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 偏铝酸钠溶液通入过量CO2:AlO2-+4CO2+2 H2O═Al3++4 HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液是盐溶液 | |
| B. | 该溶液可能是酸或碱溶 | |
| C. | 该溶液中c(OH-)=10-5mol/L | |
| D. | 该溶液与pH=9的氢氧化钠等体积混合,混合后溶液可能呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 可将地下输油钢管与外加直流电的正极相连以保护它不受腐蚀 | |
| C. | 自然界中钢铁的腐蚀以析氢腐蚀为主 | |
| D. | 生铁在海水中的腐蚀速度比在空气中快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
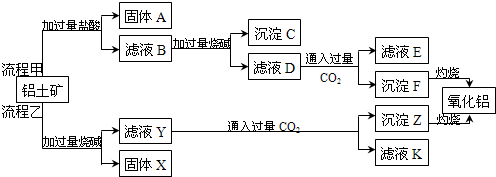
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
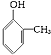 的类别是:酚.
的类别是:酚.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com