
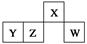
| A.原子半径:rW>rZ>rY>rX |
| B.含Y元素的盐溶液显酸性 |
| C.最简单气态氢化物的热稳定性:Z>W |
| D.X与氢元素组成的化合物XH5与水反应可产生两种气体 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稳定性:NH3<PH3<SiH4 |
| B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 |
| D.还原性:F-<Cl-<Br- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.X元素最高价氧化物对应的水化物一定是强酸 |
| B.X元素的氢化物的化学式一定为H2X |
| C.X的单质一定是良好的半导体材料 |
| D.X元素的氧化物一定能与烧碱反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的核外电子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锂(Li)与水反应比钠与水反应剧烈 |
| B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 |
| C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
| D.HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第三周期0族 | B.第三周期VIA族 |
| C.第三周期VIIA族 | D.第四周期IA族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com