
| A、将金属钠在研钵中研成粉末,以便钠与水反应的实验更安全 |
| B、用NaOH溶液浸泡铝箔,以除去其表面的氧化膜 |
| C、将10滴溴乙烷加到1 mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验溴乙烷是否发生了水解 |
| D、向新制的AgCl悬浊液中滴加KI溶液,有黄色沉淀生成,证明同温度下:Ksp(AgI)<Ksp(AgCl) |


科目:高中化学 来源: 题型:
| A、2HBrO+Na2CO3═2NaBrO+H2O+CO2↑ |
| B、HBrO+Na2CO3═NaBrO+NaHCO3 |
| C、CO2+NaBrO+H2O═NaHCO3+HBrO |
| D、CO2+2NaBrO+H2O═Na2CO3+2HBrO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某二元弱酸的酸式盐NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| B、0.1 mol?L-1 HCN与0.1 mol?L-1 NaCN等体积混合得到的碱性混合溶液中:c(Na+)<c(CN-) |
| C、在物质的量浓度均为0.01 mol?L-1 CH3COOH和CH3COONa的混合溶液中:c(CH3COOH)+c(CH3COO-)<0.02 mol?L-1 |
| D、c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:c(NH4HCO3)>c(NH4Cl)=2c[(NH4)2SO4] |
查看答案和解析>>
科目:高中化学 来源: 题型:
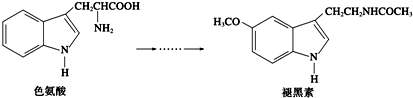
| A、色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 |
| B、在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
| C、在一定条件下,色氨酸可发生加聚反应 |
| D、褪黑素与色氨酸结构相似,也具有两性化合物的特性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正价或最低负价 | -4 | +4 |
| A、四种元素在化合物中具有一种相同的化合价,即+4 |
| B、高温下B可从C的氧化物中置换出C的单质 |
| C、四种元素的最高价含氧酸均为强酸 |
| D、只由非金属元素组成且含D元素的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,稀释0.1mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、常温下,某醋酸溶液的pH=3,将此溶液稀释10倍后,溶液的pH=4 |
| C、常温下,可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 |
| D、常温下,pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合前的醋酸约1%发生电离 |
| B、混合后的溶液中c(Na+)=c(CH3COO-) |
| C、氢氧化钠和醋酸的浓度不相等 |
| D、混合后的溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO3在反应中被氧化 |
| B、1mol NaClO3参加反应有2mol电子转移 |
| C、氧化性ClO2>NaClO3 |
| D、氧化产物与还原产物的物质的量之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com