
科目: 来源:不详 题型:填空题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) | 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+) |
| B.x=20时溶液导电能力比x=15时溶液导电能力强 |
| C.x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-) |
| D.x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
科目: 来源:不详 题型:填空题
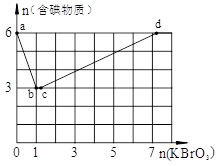
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂 |
B.在任何条件下都不能发生Cu+H2SO4=CuSO4+H2 反应 反应 |
| C.浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
| D.二氧化氮与水反应的离子方程式是3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| A.Cl- | B.NO3- | C.CO3 2- | D.OH- |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Zn+H2SO4(稀) | B.NaCl+AgNO3(溶液) |
| C.H2+O2 | D.Na2O+H2O |
查看答案和解析>>
科目: 来源:不详 题型:填空题
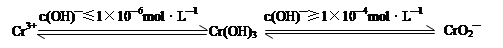

查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.①② | B.①③ | C.②③ | D.③④ |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.K+一定存在 |
| B.100 mL溶液中含0.01 mol CO32- |
| C.Cl-一定存在 |
| D.Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com