
科目: 来源:不详 题型:单选题
| A.一定条件下某密闭容器盛有0.1 mol N2和0.3 mol H2,充分反应后转移电子数为0.6NA |
| B.50mL18.4 mol·L-1浓硫酸与足量铜加热反应,生成SO2的分子数为0.46NA |
| C.一定条件下4.6g Na完全与O2反应生成7.2 g产物,失去的电子数为0.2NA |
| D.电解1L NaCl溶液至c(OH-) =" 0.2" mol·L -1,转移电子数为0.4NA(假设电解过程中溶液体积不变) |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.1 L 0.25 mol/L的Na2SO4溶液中含氧原子个数为NA |
| B.12 g石墨烯(单层)中含六元环的个数为0.5 NA |
| C.78 g苯含有碳碳双键数为3 NA |
| D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.常温下,pH=2的H2SO4溶液中含有的H+离子数目为0.01NA |
| B.当H2O与Na2O2反应生成1 molO2时,转移的电子数目为4NA |
| C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数为0.1NA |
| D.1 L 0.1 mol·L-1 FeCl3溶液中含有的Fe3+离子数目为0.1NA |
查看答案和解析>>
科目: 来源:不详 题型:问答题
查看答案和解析>>
科目: 来源:不详 题型:填空题
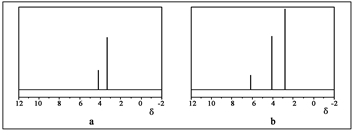
 H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA |
| B.4.2 g丙烯中所含的共用电子对总数为0.6NA |
| C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |
| D.在高温、高压、催化剂的条件下,28gN2和6gH2充分反应,生成NH3的分子数为2NA |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.由2H和18O组成的水11 g,所含的中子数为4NA |
| B.标准状况下11.2 L乙烷和乙烯的混合气体中含有C原子数为NA |
| C.在0.1 mol·L-1的醋酸溶液中,所含H+的个数小于0.1NA |
| D.室温下H2O2分解得到16 g O2,转移的电子数为2NA |
查看答案和解析>>
科目: 来源:不详 题型:单选题
A.已知N2(g)+3H2(g)  2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 2NH3(g)△H=-92.4 kJ·mol-1,当有3NA个电子转移时,△H变为-46.2 kJ·mol-1 |
| B.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
| C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| D.2.9g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.01NA个 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.标准状况下,2.24 L CCl4所含的原子数为0.5 NA |
| B.100 m L 0.1 mol/L的NaCl 溶液中,所含微粒总数为0.02 NA |
| C.1.7 g的OH-中含有的电子数为NA |
| D.78 g Na2O2与足量水反应转移电子数为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com