
科目: 来源:不详 题型:问答题
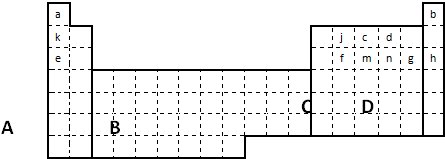
查看答案和解析>>
科目: 来源:不详 题型:填空题
族 周期 |
ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:问答题
| A.易形成-1价离子 |
| B.从上到下氢化物的稳定性依次减弱 |
| C.从上到下非金属性逐渐增强 |
| D.从上到下原子半径逐渐增大 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
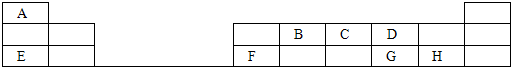
查看答案和解析>>
科目: 来源:不详 题型:填空题
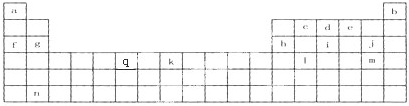
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.第16列中元素中没有非金属元素 |
| B.只有第二列的元素原子最外层电子排布为ns2 |
| C.第四周期第8列元素是铁元素 |
| D.第15列元素原子的最外层电子排布为ns2 np5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com