
科目: 来源:不详 题型:问答题
| 实验 | 实验目的 | 实验内容 |
| Ⅰ | 探究Mg、Al的金属性强弱 | 1将除去氧化膜的镁条和铝条分别投入稀盐酸中 2将除去氧化膜的镁条和铝条分别放入试管中,加入 少量水,加热至沸腾,再向溶液中滴加酚酞溶液 3向MgCl2和AlCl3溶液中分别加氨水至过量 |
| Ⅱ | 探究Cl、S的非金属性强弱 | ④分别加热密封于玻璃管中的H2S和HCl气体 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
| a | |||||||
| e | g | i | j | ||||
| b | c | d | f | h | k | l | |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.HClO4、H2SO4、H3PO4的酸性依次增强 |
| B.HCl、HBr、HI的还原性依次增强 |
| C.Al3+、Mg2+、F-粒子的半径依次减小 |
| D.K、Rb、Cs最高正价依次降低 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.原子最外层电子只有1个或2个的元素是金属元素 |
| B.16号元素原子的最外层电子数是4号元素原子最外层电子数的四倍 |
| C.11号元素与17号元素能形成XY2型化合物 |
| D.136C表示的碳原子核内有6个质子、7个中子 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
| A.R的氧化物对应的水化物可能具有两性 |
| B.X单质在氧气中燃烧不可能生成XO3 |
| C.离子半径大小:r(M3+)<r(T2-) |
| D.L2+和X2-的电子层结构相同 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.金属性逐渐减弱 |
| B.化合价逐渐升高 |
| C.失电子能力逐渐增强 |
| D.最高价氧化物对应的水化物碱性逐渐减弱 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.原子序数按X、Y、Z的顺序减小 |
| B.单质的氧化性按X、Y、Z的顺序增强 |
| C.原子半径按X、Y、Z的顺序增大 |
| D.气态氢化物的稳定性按X、Y、Z的顺序减弱 |
查看答案和解析>>
科目: 来源:不详 题型:问答题
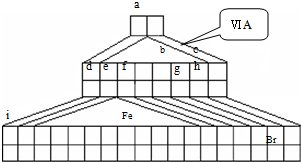

查看答案和解析>>
科目: 来源:不详 题型:问答题
| b | |||||||||||||||||
| h | j | ||||||||||||||||
| a | c | f | i | l | m | ||||||||||||
| e | g | ||||||||||||||||
| d | k | ||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com