
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:填空题
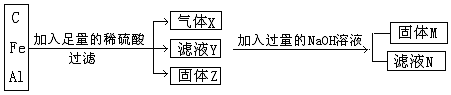
 ,还含有的溶质为 (填化学式)。
,还含有的溶质为 (填化学式)。查看答案和解析>>
科目: 来源:不详 题型:填空题
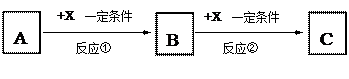
 (填序号)
(填序号) 属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Si SiO2 H2SiO3 Na2SiO3 |
| B.NH3 NO NO2 HNO3 |
| C.Cu CuO Cu(OH)2 CuSO4 |
| D.Na Na2O2 NaOH Na2CO3 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
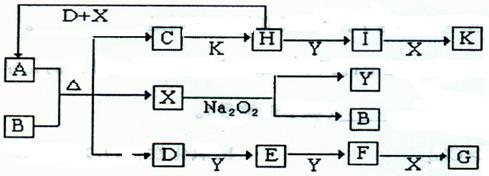
查看答案和解析>>
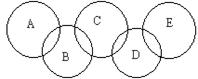
科目: 来源:不详 题型:填空题
 )写出下列化学式:A ;D ;E 。
)写出下列化学式:A ;D ;E 。 大小关系为
大小关系为查看答案和解析>>
科目: 来源:不详 题型:填空题
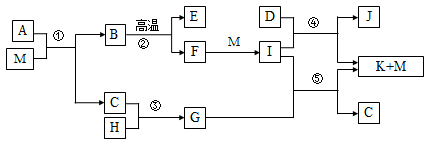
查看答案和解析>>
科目: 来源:不详 题型:填空题
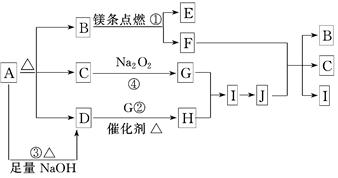
 状况下2.24 L G时,转移电子数为________ mol.
状况下2.24 L G时,转移电子数为________ mol.查看答案和解析>>
科目: 来源:不详 题型:填空题
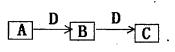
 液,产生不溶于稀硝酸的白色沉淀,则B的化学式是 。
液,产生不溶于稀硝酸的白色沉淀,则B的化学式是 。查看答案和解析>>
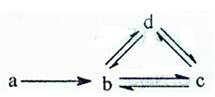
科目: 来源:不详 题型:填空题
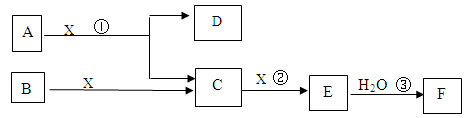
 4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是  提高C的转化率
提高C的转化率查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com